ВВЕДЕНИЕ
Змеиные яды, благодаря своему уникальному химическому составу и физиологическому действию, являясь комплексами биологически активных веществ (БАВ), в частности, токсинов и энзимов, находят всё более широкое применение в фундаментальных научных исследованиях и практической медицине в качестве терапевтических средств. В змеиных ядах выделены нсколько групп нейротоксинов: кураремиметические, мембранные, токсины с фосфолипазной структурой, кротаминовые и ряд других [3]. Помимо токсинов в змеиных ядах содержится целый ряд энзимов, вызывающих эффекты локального капиллярного повреждения и тканевого некроза при активации протеиназ, фосфолипаз; ускорение или замедление гемокоагуляции; острую гипотензию и боль, связанные с высвобождением вазоактивных пептидов и кениногеназы. В исследованиях [2], была показана модулирующая и протекторная роль кортикостероидного гормона – дексаметазона и нового гипоталамического пролином богатого полипептида (ПБП), открытого А. А. Галояном и сотр. [1], на модели острой нейродегенерации интернейронов спинного мозга (CМ) крыс, вызванной ядами гадюки, гюрзы и кобры [4].
Исходя из рассмотрения системы нейроэндокринной регуляции клетки (СНК), известно, что данную систему помимо тиреоидных гормонов (ТГ) и стероидных гормонов (СГ), составляют также нейромедиаторы (НМ), одним из которых является ацетилхолин (АХ), являющийся одним из эфиров холина (ХЛ) [5]. Известно, что ХЛ (от греч, choly – жёлчь), гидроокись 2- ксиэтилтриметиламмония, [(CH3)3N+CH2CH2OH] OH-. Бесцветные кристаллы, хорошо растворимые в воде, этиловом спирте, нерастворимые в эфире, бензоле. ХЛ легко образует соли с сильными кислотами, его водные растворы обладают свойствами сильных щелочей. ХЛ широко распространён в живых организмах. ХЛ входит в состав фосфолипидов (например, лецитина, сфингомиелина), служит источником метильных групп в синтезе метионина [6]. Исследования [7 – 11] свидетельствуют о том, что в коррегировании соматических и нейрогенных нарушений невторостепенна роль эфиров и амидов холина, заслуживающих существенного внимания с точки зрения особенностей их синтеза и биологической активности (БА). Также в работах [12, 13] нами изучено действие некоторых эфиров и амидов холина на показатели БА нейрональных элементов СМ в норме и при его органических повреждениях (ОПСМ). В работах [14 – 18] исследовано действие эфиров холина на изменение показателей ТТГ, общего Т3 и Т4 в крови у крыс различных возрастных групп при патологиях ЩЖ типа гипотиреоза.
С целью дальнейшего изучения нейродегенеративных изменений вызванных змеиными ядами, в данной работе приводятся результаты экспериментов на ранее неисследованных, подверженных
интоксикации ядом кобры мотонейронах (МН) СМ крыс, и эффекты последующего влияния одного из производных холина, относящегося к холиновым эфирам N – замещённых – α, β – дегидроаминокислот (ХЭА) – холинового эфира N – (2-метоксибензоил) – О – изопропил – α, β – дегидротирозина (ХЭ) на электрическую активность данных нейронов. В отдельной серии исследований, у крыс, подверженных интоксикации ядом кобры в сыворотке крови, методом иммуноферментного анализа (ИФА), было исследовано действие сверхмалых доз (СМД) ХЭ на изменение показателей тиреотропного гормона гипофиза (ТТГ), общего трийодтиронина (Т3) и тироксина (Т4).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на 60 крысах-самцах (линия Вистар, массой 250 – 300 г., возраст – 12 – 15 месяцев). В первой и второй серии экспериментов – в острых опытах на 30 спинальных животных, микроэлектрофизиологическими методами исследовали внеклеточную фоновую и вызванную активность (ФА и ВА) МН СМ в ответ на стимуляцию флексорного нерва нижней конечности. Отведение активности МН проводили микроэлектродом с диаметром кончика 1 – 2 микрон (мкм) в сером веществе передних рогов поясничного отдела СМ в области МН (IX пластина по Рекседу). Регистрацию и анализактивности МН проводили с помощью специально разработанной программы на компьютере, беспечивающей в режиме on-line селекцию спайков посредством амплтудной дискриминации спайка и последующим построением кумулятивной импульсной гистограммы для выбора необходимого режима записи ФА и ВА одиночного нейрона. Исследованные МН подвергали острой интоксикации ядом среднеазиатской кобры (Naja naja oxiana) в дозе LD-50, равной 3, 4 мг/кг массы тела. ХЭ вводили внутримышечно, в СМД 10-17 М.
Во третьей серии экспериментов – на 30 спинальных животных подверженных острой интоксикации ядом среднеазиатской кобры (Naja naja oxiana) в дозе LD-50, равной 3, 4 мг/кг массы тела, исследовали действие СМД ХЭ 10-17 М. Затем, методом ИФА определялась концентрация ТТГ, общего Т3 и общего Т4, посредством ИФАН RISER 8793. Принцип работы набора заключается в том, что определение уровня ТТГ (или ТГ) основано на использовании конкурентного варианта твердофазного ИФА. На внутренней поверхности лунок планшета иммобилизованы машинные моноклональные антитела к ТТГ (или ТГ). В лунке планшета вносят исследуемый образец и конъюгат (Т4, конъюгированный с пероксидазой). Во время инкубации ТТГ (или ТГ) образца конкурирует с конъюгированным ТТГ (или ТГ) за связывание с антителами на поверхности лунки. В результате образуется связанный с пластиком «сэндвич», содержащий пероксидазу. Во время инкубации с раствором субстрата тетраметилбензидина происходит окрашивание растворов в лунках. Интенсивность окраски обратно пропорциональна концентрации ТТГ (или ТГ) в исследуемом образце. Концентрацию ТТГ (или ТГ) в исследуемых образцах определяют по калибровочному графику зависимости оптической плотности от содержания ТТГ (или ТГ) в калибровочных пробах. Статистическая обработка результатов данной серии исследований производилась в среде Statistica 6.0 for Windows по методу ANOVA с post-hoc анализом по U-критерию Манна-Уитни. Сравнение полученных результатов до и после воздействия производилось по критерию Вилкоксона для непараметрических данных, разброс данных на рисунках – стандартное отклонение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
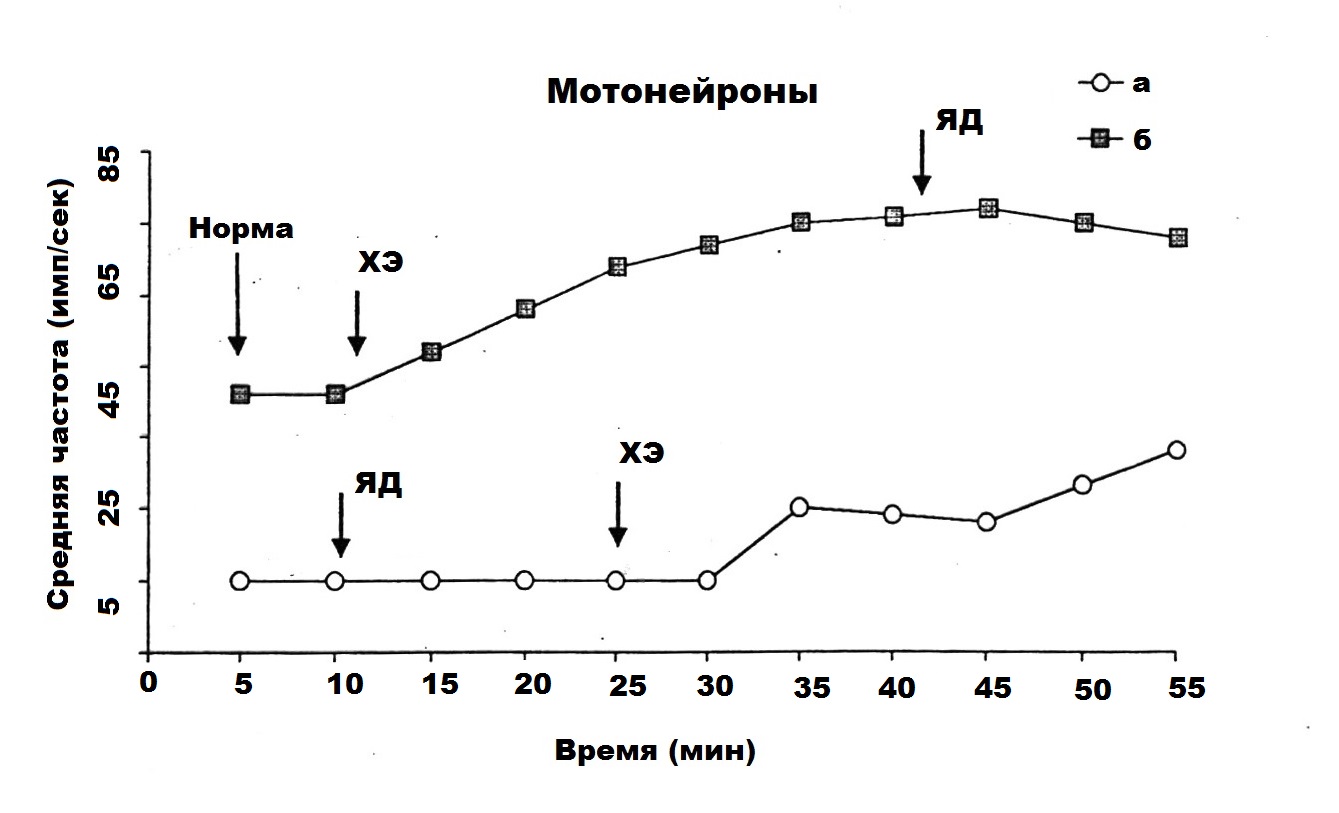
Первоначально исследовалась ФА МН в передних рогах СМ при интоксикации их ядом кобры с последующим действием на эти нейроны СМД ХЭ 10-17 М. Изучена активность 30 МН, из которых только 18 МН обладали фоновой ритмикой. На основании анализа величин средних частот ФА данных МН показано, что в норме у 18 МН средняя частота ФА ровнялась 22 имп/сек, после введения яда кобры в таком же количестве МН она подавлялась до 6 имп/сек, а в результате последующего действия СМД ХЭ 10-17 М она составляла – 18 имп/сек.
На рис. 1 показан пример двух фоновоактивных МН на глубине 1100 (а) и 1300 (б) мкм при предварительном и последующим действием ХЭ на нейроны, подвергшиеся влиянию яда. На нижнем графике (а) яд кобры вызывает резкое урежение средней частоты разрядов МН, введение же ХЭ на 40 минуте восстанавливает подавленную фоновую ритмику нейрона с тенденцией, ведущей к возвращению к норме. На другом графике (б) предварительное введение ХЭ вызывает учащение фоновой ритмики МН, а последующее введение яда кобры на фоне действия холинового эфира не оказывает отрицательного влияния на показатели его средней частоты.
В другой серии экспериментов исследовалась ВА МН СМ подверженных комбинированному действию яда кобры и СМД ХЭ 10-17 М.
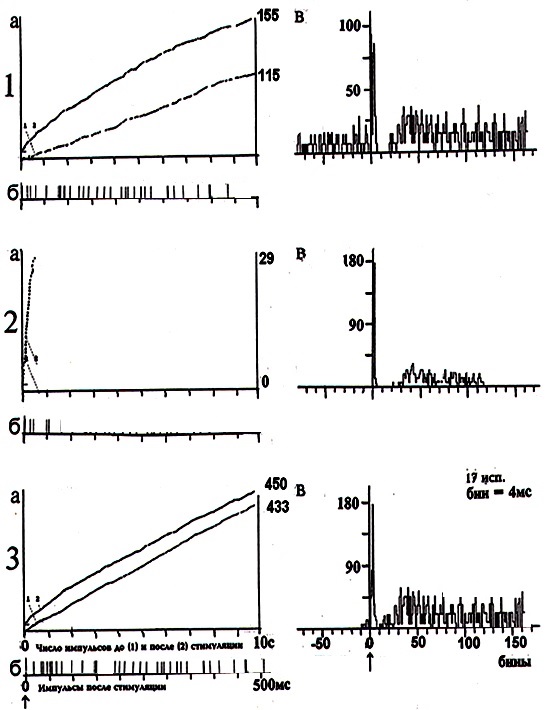
Рис. 2 демонстрирует пример кумулятивной (рис. 2, а) и суммированной (рис. 2, в) пре – и постстимульных гистограмм импульсных потоков активности МН на глубине 1400 мкм. Как видно из рисунка, влияние яда кобры на нейрональную активность фоновоактивного МН проявлялось спустя 5 минут в виде полного торможения ФА одиночного МН (рис. 2, 2а, нижняя кривая); на
раздражение флексорного нерва МН отвечал серией судорожных, «пачечного» типа, разрядов (рис. 2, 2а, верхняя кривая). На суммированной постстимульной гистограмме ВА нейрона отмечалось угнетение позднего асинхронного компонента клеточного ответа вследствие влияния яда (рис. 2, 2в). Последующее введение на 25 минуте ХЭ проявлялось спустя 5 минут в восстановлении регулярного типа ФА МН (рис. 2, 3а, нижняя кривая) и в более выраженном, по сравнению с нормой, усилении как постстимульного кумулятивного импульсного потока (рис. 2, 3а, верхняя кривая), так и постстимульных раннего и позднего компонентов ответа МН
(рис. 2, 3в).
Исходя из вышесказанного, можно сделать вывод о возможности предотвращения токсического действия яда кобры на нейроны СМ, применение СМД ХЭ.
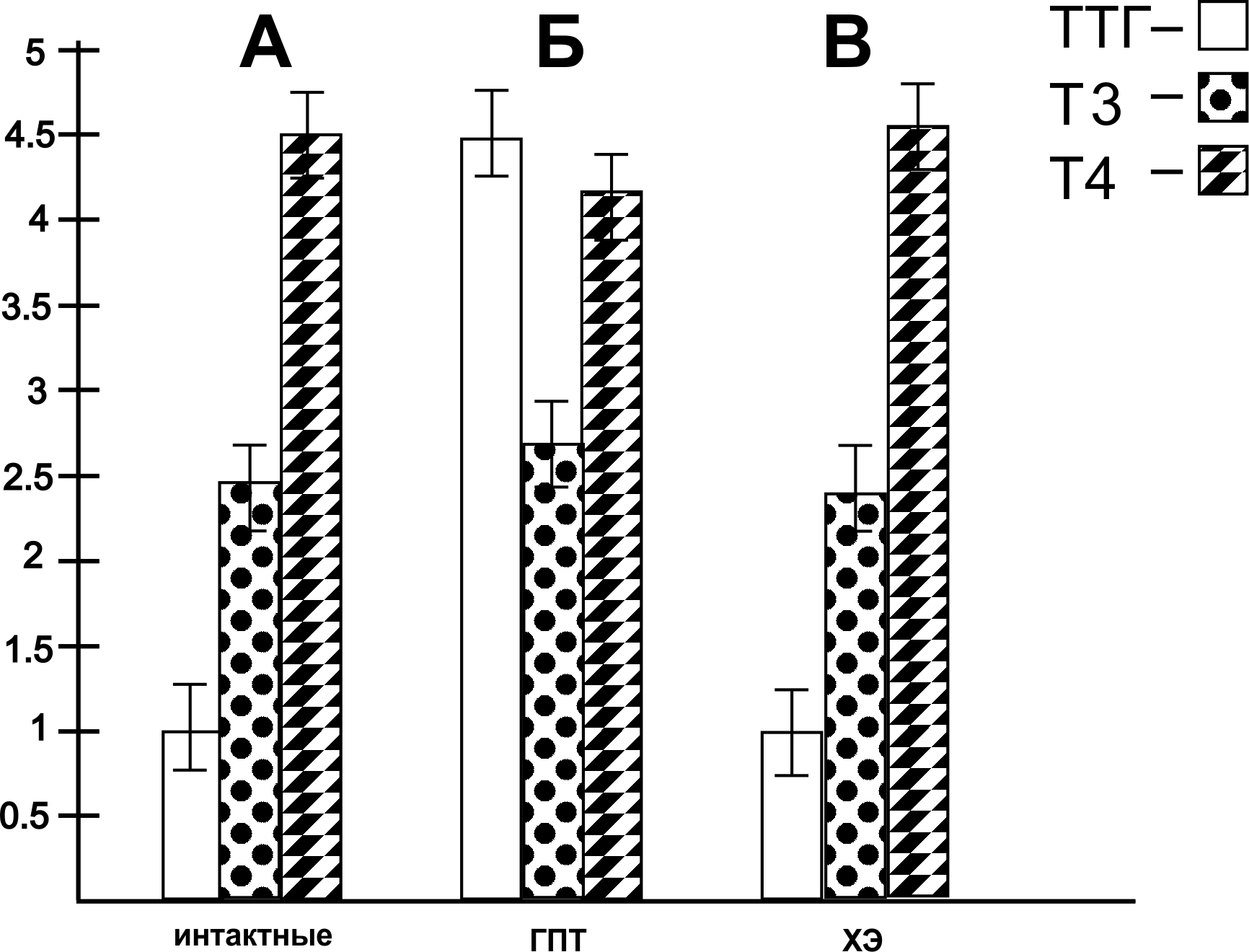
В следующей серии исследований представлены результаты ИФА изменения концентрации ТТГ и ТГ в сыворотке крови у крыс при интоксикации их ядом кобры до и после воздействия ХЭ в вышеказанных дозах. Как видно на рис. 3, Б – после воздействия яда кобры происходило к значительное повышение содержания ТТГ на 420 % (рис. 3, Б); содержание общего Т3 у крыс с СГПТ понижалось на 45 % по сравнению с животными, не получавшими яда кобры (рис. 3, Б); содержание же общего Т4 понижалось на 79 % (рис. 3, Б). После введения СМД ХЭ в дозе 10-17 М у крыс с интоксикацией ядом кобры были отмечены следующие показатели: содержание ТТГ в крови составило 98, 5 % по сравнению с животными, не получавшими ХЭ (рис. 3, В); содержание общего Т3 составило 77, 9 %; содержание общего Т4 составило 82, 7 % (рис. 3, В).
Полученные в данной серии исследований данные свидетельствуют о том, чти применение СМД ХЭ способствовало нормализации практически до нормы вышеуказанных показателей ТТГ и ТГ в сыворотке крови у крыс, подверженных действию яда кобры.
ОБСУЖДЕНИЕ
В свете полученных экспериментальных данных, становится очевидным факт протекторного действия ХЭ как на ФА одиночных МН в вентральных рогах СМ, подверженных острой интоксикации ядом кобры, так и на вызванную постсинаптическую внеклеточно регистрируемую активность одиночных МН. По имеющимся литературным данным, предполагаемый механизм действия ингибирующего сигнала на мембрану, вызванный влиянием цитотоксинов ядов усиливаемых ферментом фосфолипазой А2 приводит к уменьшению количества аденилатциклазы, что в свою очередь ведёт к уменьшению цАМФ и снижению деполяризации мембраны, приводящий к торможению импульсного ответа нейрона [1, 4, 19]. Возможен и пресинаптический механизм действия змеиных ядов, осуществляемый посредством того же фермента фосфолипазы А2, потенцируемый действием цитотоксинов ядов на биомембраны и вызывающий истощение запасов ацетилхолина в нервных окончаниях [20].
Как показали вышеизложенные результаты исследований, нейродегенеративные изменения МН СМ, сопряжённые с его электрической активностью, могут быть восстановлены при воздействии на эти клетки ХЭ. Данное протекторное влияние ХЭ на повреждённые интоксикацией ядами МН, вероятно, осуществляется через его действие на молекулярные механизмы повреждённых МН.
Стимулирующее действие ХЭ можно объяснить, во-первых, действием на мембрану повреждённых нейронов активирующей циклазной системы, то есть увеличением от нейротрансмиттерного сигнала мембранного фермента – аденилатциклазы с последующим синтезом при участии АТФ циклического АМФ, деполяризующего мембрану клетки и усиливающего её ответ на внешнюю стимуляцию, и, во-вторых, механизмом торможения ХЭ фосфолипазы А2 – фермента, присутствующего во всех змеиных ядах и оказывающего токсическое влияние на нервные клетки [21]. Протекторная роль СМД ХЭ в данных сериях исследований подтверждается и при ИФА изменения концентрации ТТГ и ТГ в сыворотке крови у крыс при интоксикации ядом кобры.
Наряду с ранее опубликованными данными литературы относительно нейропротекторной функции ХЭ в организме млекопитающих [10, 11], настоящим исследованием на основе представления о том, что эндокринная система организма играет важную роль в патогенезе отравления ядами, и факта активного взаимодействия ядов с гормонами и нейромедиаторами, авторами выдвигается предположение о протекции СМД ХЭ нейродегенерации МН СМ, вызванной ядом кобры, которое даёт основание рекомендовать применение СМД ХЭ в клинической практике в качестве эффективного средства при интоксикациях змеиными ядами.
Кумулятивные (а) и суммированные (в) пре- и постстимульные гистограммы внеклеточной импульсной активности одиночного мотонейрона спинного мозга (глубина 1400 мкм) в ответ на раздражение флексорного нерва в норме (1, а, б, в); на 5 мин. действия яда кобры (2, а, б, в); на 25 мин. введения сверхмалой дозы холинового эфира N – (2-метоксибензоил) – O – изопропил – α, β – дегидротирозина (3, а, б, в). На «а»: ордината – число импульсов до и после стимуляции нерва, абсцисса – время регистрации импульсного потока. На «б»: картина импульсного потока после стимуляции нерва в избранном интервале времени. На «в»: ордината – процент импульсов (в бинах) от числа проб, абсцисса – последовательность бинов.
Графики изменения величин средних частот фоновой активности двух мотонейронов спинного мозга (а, б) при комбинированном действии яда кобры и сверхмалой дозы холинового эфира N – (2-метоксибензоил) – O – изопропил – α, β – дегидротирозина.
Диаграммы изменения концентрации тиреотропного гормона гипофиза и тиреоидных гормонов в сыворотке крови у крыс в норме (А), при интоксикации ядом кобры (Б) и после действия холинового эфира N – (2-метоксибензоил) – О – изопропил – α, β – дегидротирозина в сверхмалой дозе 10-17 М (В).
Библиографический список
- Galoyan A. A., Kipriyan T. K., Sarkissian J. S. et al. Protection against snake venom-induced neuronal injury by new hypothalamic neurohormone. J. Neurochemical Research, 2000, № 5, pp. 791 – 800.
- Galoyan A. A. Neurochemistry of brain neuroendocrine immune system: single molecules. J. Neurochemical Research, 2001, v. 25, pp. 1343 – 1355.
- Carlson E. Snake venoms. Chemistry of protein toxins in snake venoms. In: Berlin – Heidelberg – New – York: Springer – Verlag, 1979, ch. 5, pp. 159 – 212.
- Киприян Т. К., Амирян С. В., Аветисян З. А., Хачатрян Т. С. Протекция дексаметазоном острой нейродегенерации интернейронов спинного мозга крыс вызванной змеиными ядами. Ж. Вестник МАНЭБ, 2002, т. 7, № 4, с. 155 – 158.
- Киприян Т. К., Топузян В. О., Карапетян И. Р., Хачатрян Т. С. Анализ влияния сочетанного комплекса тироксина и йодметилата 2 – (диметиламно) этилового эфира – N – (п – метоксибензоил) – DL – фенилаланина на электрическую активность повреждённых травмой одиночных мотонейронов спинного мозга крыс. В сб. Международная научная конференция «Актуальные проблемы интегративной деятельности и пластичности нервной системы» посвящ. 80 – летию со дня рождения академика НАН РА и чл. – корр. РАН В. В. Фанарджяна, 2009, Ереван, Изд. «Гитутюн» НАН РА, с. 154 – 158.
- Zeisel S. H. Nutritional Importance of Choline for Brain Development. J. Am. J. Clin. Nutr., 2004, № 90006, pp. 621 – 626
- Матинян Л. А., Нагапетян Х. О., Хачатрян Т. С. Протекция сочетанным комплексом тироксина и йодметилата 2 – (диметиламно) этилового эфира – N – (п – метоксибензоил) – DL – фенилаланина вызванной активности одиночных мотонейронов спинного мозга крыс при экспериментальном гипотиреозе. В сб. Международная научная конференция «Актуальные проблемы интегративной деятельности и пластичности нервной системы» посвящ. 80 – летию со дня рождения академика НАН РА и чл. – корр. РАН В. В. Фанарджяна, 2009, Ереван, Изд. «Гитутюн» НАН РА, с. 175 – 178.
- Киприян Т. К., Топузян В. О., Карапетян И. Р., Арутюнян Э. Ю., Хачатрян Т. С. Влияние йодметилата 2 – (диметиламно) этилового эфира – N – (п – метоксибензоил) – DL – фенилаланина на фоновую и вызванную активность одиночных пирамидных нейронов IV слоя коры больших полушарий головного мозга крыс при латеральной гемисекции спинного мозга. Ж. Мед. Наука Армении, 2009, № 2, т. XLIX, с. 31 – 34.
- Хачатрян Т. С., Топузян В. О., Карапетян И. Р., Арутюнян Э. Ю., Киприян Т. К. Эффекты малых доз йодметилата 2 – (диметиламино) этилового эфира – N – (п – метоксибензоил) – DL – фенилаланина на вызванную электрическую активность одиночных мотонейронов спинного мозга крыс при латеральной гемисекции спинного мозга. Ж. Биолог. Журн. Армении, 2009, № 2, т. 61, с. 53 – 56.
- Киприян Т. К., Топузян В. О., Карапетян И. Р., Хачатрян Т. С. Влияние йодметилата 2 – (диметиламно) этилового эфира – N – (п – метоксибензоил) – DL – фенилаланина на фоновую и вызванную активность одиночных мотонейронов спинного мозга до и после его гемисекции. Ж. ДАН РА, 2009, № 2, т. 130, с. 183 – 187.
- Хачатрян Т. С. Сравнительный анализ влияния сочетанного комплекса тироксина и йодметилата 2 – (диметиламино) этилового эфира N – (п – метоксибензоил) – DL – фенилаланина на электрическую активность повреждённых травмой одиночных интернейронов спинного мозга крыс. Ж. Вестник МАНЭБ, 2009, № 4, т. 14, вып. 1, с. 104 – 107.
- Хачатрян Т. С., Топузян В. О., Карапетян И. Р., Киприян Т. К. Протекция йодметилатом 2 – (диметиламино) этилового эфира N – (п – метоксибензоил) – DL – фенилаланина изменений вызванной активности повреждённых травмой одиночных интернейронов спинного мозга крыс. Ж. Биолог. Журн. Армении, 2009, № 3, т. LXI, с. 6 – 9.
- Хачатрян Т. С., Топузян В. О., Карапетян И. Р., Арутюнян Э. Ю., Киприян Т. К. Ферментотерапия в сочетании с йодметилатом 2 – (диметиламино) этилового эфира N – (п – метоксибензоил) – DL – фенилаланина при органических повреждениях спинного мозга. Ж. Биолог. Журн. Армении, 2009, № 4, т. LXI, с. 7 – 11.
- Хачатрян Т. С. Особенности изменения концентрации тиреотропного гормона гипофиза и тиреоидных гормонов в крови у двухмесячных крыс при субклиническом гипотиреозе до и после действия холинового эфира N-бензоил-О-метил-α, β-дегидротирозина. // Исследования в области естественных наук. – Октябрь, 2012. [Электронный ресурс]. URL: http://science.snauka.ru/2012/10/1983
- Хачатрян Т. С. Особенности изменения концентрации тиреотропного гормона гипофиза и тиреоидных гормонов в крови у двенадцатимесячных крыс при экспериментальном гипотиреозе до и после действия холинового эфира N-(4-бромбензоил) -α, β-дегидрофенилаланина. // Современные научные исследования и инновации. – Октябрь, 2012. [Электронный ресурс]. URL: http://web.snauka.ru/issues/2012/10/17937.
- Хачатрян Т. С. Изменение концентрации тиреотропного гормона гипофиза и тиреоидных гормонов в крови у шестимесячных крыс при гипотиреозе. Ж. Биолог. Журн. Армении, 2013, № 1, т. 65, с 89 – 92.
- Хачатрян Т. С., Топузян В. О. Роль холинового эфира N-(2-метоксибензоил) – О-изопропил -α, β – дегидротирозина в изменении концентрации тиреотропного гормона гипофиза и тиреоидных гормонов в крови двенадцатимесячных крыс при экспериментальном гипотиреозе. Ж. ДАН РА, 2013, т. 113, № 1, с. 69 – 73.
- Хачатрян Т. С., Топузян В. О. Особенности изменения концентрации тиреотропного гормона гипофиза и тиреоидных гормонов в крови двухмесячных крыс при гипотиреозе до и после действия холинового эфира N-(2-метоксибензоил) – О-изопропил -α, β – дегидротирозина. Ж. ДАН РА, 2013, т. 113, № 3, с.290 – 294.
- Lester H. A. Postsynaptic action of cobra toxin at the myoneural junction. // Nature, 1970, v. 227, № 5250, pp. 727 – 728.
- Wilson H. I., Nicholson G. M. Presynaptic snake-neurotoxins produce tetanic fade endplate potential rundown during neuromuscular blocade in the mouse diaphragm. // Archives of Pharmacology, 1997, v. 356, № 5, pp. 626 – 634.
- Срапионян Р. М., Бабаян М. А., Симонян М. А. Исследование индивидуального и сочетанного влияния гипоталамо-нейрогипофизарных гормонов и яда змеи (Vipera lebetina) на уровни про- и антиоксидантных металлопротеинов в крови и ряде органов крыс. Ж. Нейрохимия, 2004, т. 21, № 2, c. 125 – 128.