Согласно существующим на настоящий момент представлениям в технической и научной литературе описываются несколько механизмов работы свинцового аккумулятора [1 – 5], при этом общий принцип его работы трактуется всеми авторами одинаково и базируется на положениях теории «двойной сульфатации».
При этом активными веществами заряженного аккумулятора, участвующими в токообразующих процессах, являются диоксид свинца РbО2 на положительном электроде, губчатый свинец Рb на отрицательном электроде и электролит − водный раствор серной кислоты H2SO4. Серная кислота является сильным электролитом. Она частично диссоциирована на положительные и отрицательные ионы: Н+ и SO42−.
На отрицательном электроде свинец, частично растворяясь в электролите, выделяет в раствор положительные ионы Рb2+. При этом на электроде остаются избыточные электроны, которые сообщают ему отрицательный заряд и движутся по внешнему участку замкнутой электрической цепи в направлении к положительному электроду.
Ионы двухвалентного свинца вступают в реакцию с сульфатными ионами серной кислоты, в результате чего образуется сернокислый свинец, который, обладая очень малой растворимостью в сернокислотном электролите, осаждается на поверхности отрицательного электрода. Таким образом, в процессе разряда активная масса отрицательного электрода превращается из губчатого свинца в сернокислый свинец.
На положительном электроде потенциал образуется в результате перехода четырехвалентных ионов свинца Рb4+ из электролита на поверхность электрода. Диоксид свинца РbО2 растворяется в электролите в очень малой степени, образует с водой химическое соединение Pb(OH)4 − гидрат диоксида свинца, молекула которого в электролите распадается на четырехзарядный ион свинца Рb4+ и четыре однозарядных иона гидроксила 4ОН−.
Так как диоксид свинца обладает в растворе серной кислоты высоким положительным потенциалом, то он принимается в качестве положительной активной массы свинцовых аккумуляторов. Ионы четырехвалентного свинца Рb4+ переходят на поверхность электрода, сообщая ему положительный заряд, а отрицательные ионы гидроксила 4ОН−
остаются в электролите. Таким образом, на границе между электродом и электролитом образуется двойной электрический слой. В этом случае электрод будет заряжен положительно, а прилегающий к нему слой электролита отрицательно.
Концентрация ионов четырехвалентного свинца также зависит от плотности электролита. Чем выше плотность электролита, тем выше потенциал электрода. При обычных плотностях электролита потенциал положительного электрода в заряженном состоянии равен примерно 1,68 В.
Если замкнуть внешнюю цепь, то под действием ЭДС аккумулятора в ней потечет электрический ток по направлению от положительного электрода к отрицательному. Электроны, накопившиеся на отрицательном электроде, будут перетекать по внешней цепи в противоположном направлении [2].
Каждые два электрона, поступившие с отрицательного электрода, будут восстанавливать на положительном электроде положительный ион четырехвалентного свинца до двухвалентного иона свинца Рb2+, который переходит в электролит и соединяется с ионом SO42−, образуя молекулу сульфата свинца. Сульфат свинца, обладая малой растворимостью, отлагается на поверхности положительного электрода в виде мелких кристаллов. Наряду с этим процессом происходит взаимодействие гидроксильных ионов (4ОН−), образовавшихся в результате распада гидроксила свинца Рb (ОН)4 на ионы, с четырьмя ионами водорода (4Н+) − продуктами диссоциации серной кислоты, в результате чего образуются четыре молекулы воды. Следовательно, на каждые две израсходованные молекулы серной кислоты и две молекулы воды образуются вновь четыре молекулы воды. Таким образом, плотность электролита в процессе разряда аккумулятора будет постоянно понижаться.
На отрицательном электроде, по мере перехода электронов во внешнюю цепь, происходит окисление свинца до двухвалентных ионов Рb2+. Эти ионы свинца будут переходить в раствор серной кислоты − электролит − и взаимодействовать с ионами SО42−, образуя также сульфат свинца, который будет осаждаться на поверхности отрицательного электрода. Процесс разряда свинцового аккумулятора записывается следующим уравнением:
РbО2 + 2H2SO4 + Pb → 2PbSO4 + 2Н2О. (1)
Схематическое изображение электродных процессов, протекающих при разряде свинцового аккумулятора, представлено на рисунке 1 [2].
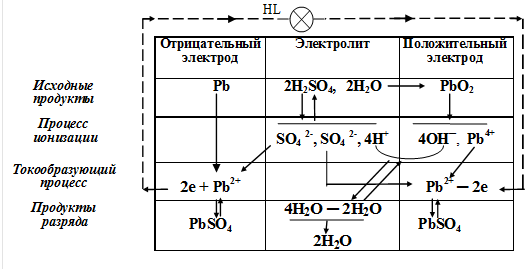
Рисунок 1 − Схема электрохимических процессов при разряде
свинцового аккумулятора
Как видно из рассмотренных электродных процессов, при разряде аккумулятора в сульфат свинца переходят активные массы как положительного, так и отрицательного электродов, то есть происходит «двойная сульфатация».
При заряде аккумулятора необходимо к его электродам присоединить источник тока, напряжение которого превышает ЭДС аккумулятора. При этом положительный полюс подключается к положительным электродам, а отрицательный полюс − к отрицательным электродам. Ток будет протекать через аккумулятор в направлении, обратном току разряда. Электроны будут перетекать с положительных на отрицательные электроды. Изменится также направление движения ионов в электролите. Ионы свинца Рb2+ будут переходить из электролита на электроды, а четырехвалентные ионы свинца Рb4+ − в электролит.
Схематическое изображение электродных процессов, протекающих при заряде свинцового аккумулятора, представлено на рисунке 2 [2].




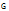
Рисунок 2 − Схема электрохимических процессов при заряде
свинцового аккумулятора
Образовавшийся на положительном и отрицательном электродах в процессе разряда сульфат свинца переходит при заряде в электролит и распадается на ионы Рb2+ и SO42─. Вода же диссоциирует частично на ионы водорода Н+ и ионы гидроксила ОН─.
При прохождении электрического тока ионы свинца Рb2+ на положительном электроде будут окисляться до четырехвалентного свинца Рb4+, отдавая два электрона во внешнюю цепь. В свою очередь, ионы Рb4+ будут соединяться с четырьмя гидроксильными ионами, полученными при диссоциации воды, образуя молекулу диоксида свинца РbО2. В результате взаимодействия ионов водорода Н+ с ионами SO42─ образуется молекула серной кислоты H2SO4.
На отрицательном электроде ионы свинца Рb2+ получают из внешней цепи по два электрона и восстанавливаются до губчатого свинца, а ионы водорода Н+, соединяясь с ионами сульфата SO42─, образуют молекулу серной кислоты.
Согласно теории «двойной сульфатации» [4] процессы заряда в свинцовом аккумуляторе протекают по уравнению
2PbSO4 + 2Н2О → РbО2 + Pb + 2H2SO4. (2)
Таким образом, при заряде свинцового аккумулятора на обоих электродах происходит образование исходных веществ: на положительном электроде образуется диоксид свинца, на отрицательном − губчатый свинец, а вода заменяется на серную кислоту, в результате чего повышается концентрация электролита.
При этом по существующим представлениям о протекании электрохимических процессов в аккумуляторе, повышение концентрации серной кислоты происходит больше у положительных электродов, чем у отрицательных [2]. Это объясняется тем, что ионы SO42─ движутся в данном случае от отрицательного к положительному электроду. Исходя из скоростей движения ионов Н+ и SO42─ в электролите, установлено, что прирост концентрации серной кислоты у положительных электродов приблизительно в 1,4 раза выше, чем у отрицательных электродов. При разряде картина будет обратной. Поэтому, учитывая это обстоятельство, на практике принимают меры к улучшению циркуляции электролита у положительных электродов.
Так, например, в стартерных аккумуляторных батареях используют сепараторы, имеющие на стороне, обращенной к поверхности положительного электрода, специальные ребра для увеличения объема электролита у этого электрода.
Плотность электролита при заряде аккумулятора повышается до тех пор, пока весь сульфат свинца не преобразуется в активные вещества. Прекращение повышения плотности электролита при заряде служит признаком окончания заряда аккумулятора. При дальнейшем заряде происходит разложение воды нa водород и кислород, которые, выделяясь
из электролита в виде газовых
пузырьков, вызывают его кипение.
Несколько отличается от описанного выше механизм работы свинцового аккумулятора согласно [3].
Основное отличие предложенного механизма работы свинцового аккумулятора заключается в механизме образования двойного электрического слоя на поверхности положительного электрода аккумулятора и связанных с этим особенностей протекания токообразующих реакций в аккумуляторе.
Так, предполагается, что в результате взаимодействия молекул диоксида свинца с электролитом некоторое количество молекул диоксида свинца ионизируется. При этом двухзарядные отрицательные ионы кислорода (О2−) переходят в электролит, а четырехзарядные положительные ионы свинца (Рb4+) остаются на поверхности положительного электрода. Положительные ионы свинца, остающиеся на поверхности электрода, притягивают к себе отрицательные ионы кислорода и не дают им возможности распространяться вглубь раствора. Таким образом, на границе положительного электрода с раствором электролита возникает двойной электрический слой: положительные ионы свинца на поверхности электрода и отрицательные ионы кислорода на границе соприкосновения электролита с поверхностью электрода. При этом общий токообразующий процесс в аккумуляторе протекает согласно уравнению [4] теории «двойной сульфатации»
РbО2 + Pb + 2H2SO4 ↔ 2PbSO4 + 2H2O. (3)
Таким образом, в технической литературе [2, 3, 4, 6, 7] в настоящее время имеет место различное толкование механизма токообразующих процессов, протекающих на электродах свинцового аккумулятора, хотя все они и базируются на положениях теории «двойной сульфатации». При этом в работе [8] делается вывод о том, что химическая реакция в обратимо действующем свинцовом аккумуляторе протекает в соответствии с уравнением (3), «… однако этот вывод совершенно не дает оснований утверждать, что и
реальный процесс обычного разряда
свинцового аккумулятора
тоже сопровождается
химической реакцией (3)».
Стоит отметить, что в настоящее время не существует прямых физических измерений атомарного состава элементов электролита и активной массы электродов свинцовых аккумуляторов непосредственно участвующих в токообразующих реакциях. Именно эти измерения могли бы служить достоверным доказательством основных положений теории «двойной сульфатации».
Вместе с тем из изложенного материала не вполне понятно, каким образом при протекании токообразующих сопряженных электродных реакций при разряде аккумулятора по уравнению (1) на отрицательном и положительном электродах выделяется различное количество участвующих в реакции активных веществ, обладающих разными по величине зарядами.
Кроме того, в известных механизмах [2 – 4, 9] в первичной токообразующей электродной реакции на положительном электроде в одном электрическом поле одновременно участвуют как положительно, так и отрицательно заряженные ионы электролита. Это не согласуется с положениями о протекании тока в электролитах, в соответствии с которыми заряды ионов, образующих электрический ток в электролите под действием приложенного к нему электрического поля, должны быть равны по величине, но противоположны по знаку, а электродные реакции должны быть сопряженными [9].
Обозначенные противоречия требуют дальнейшего изучения и обоснования.
Библиографический список
- Дасоян, M.А. Производство электрических аккумуляторов [Текст]: уч. пособие / М.А. Дасоян, В.В. Новодережкин, Ф.Ф. Томашевский; под ред.М.А. Дасояна. − М.: Высшая школа, 1965. – 468 с.
- Болотовский, В.И. Эксплуатация, обслуживание и ремонт свинцовых аккумуляторов [Текст] / В.И. Болотовский, З.И. Вайсгант. − Л.: Энергоатомиздат. Ленингр. отд-ние, 1988. − 208 с.
- Белогуров, И.Г. Стартерные кислотные аккумуляторы [Текст] / И.Г. Белогуров. − М.: Воениздат, 1960. −168 с.
- Дасоян, М.А. Современная теория свинцового аккумулятора [Текст] / М.А. Дасоян, И.А. Агуф. − Л.: «Энергия», 1975. − 312 с.
- Долецалек, Ф. Теория свинцового аккумулятора [Текст] / Ф. Долецалек. – М. – Л.: ОНТИ «Энергоиздат», 1934. – 155 с.
- Акимов, С.В. Электрооборудование автомобилей [Текст]: учебник для вузов / С.В. Акимов, Ю.П. Чижков. −М.: ЗАО КЖИ «За рулем», 2003. − 384 с.
- Ютт, В. Е. Электрооборудование автомобилей [Текст] / В. Е. Ютт. – М. : Горячая линия – Телеком, 2009. – 440 с.
- Лоренц, А.К. К вопросу о термодинамическом обосновании теории двойной сульфатации [Текст]: сб. науч.-исслед. раб. по химич. источн. тока / А.К. Лоренц. − М. − Л.: ЦАЛ, 1939. − Вып. 4. − С. 35−54.
- Багоцкий, В.С. Химические источники тока [Текст] / В.С. Багоцкий, А.М. Скундин. − М.: Энергоиздат, 1981. − 360 c.