Согласно теории «двойной сульфатации» химический процесс, связанный с прохождением электрического тока через свинцовый аккумулятор, протекает на поверхностях электродов аккумулятора в соответствии с уравнением (1):
PbO2 +Pb + 2H2SO4 ↔ 2PbSO4 + 2H2 (1).
Направление реакции слева направо соответствует разряду и обратное направление − заряду аккумулятора. При этом на поверхности электродов аккумулятора происходит превращение активных веществ в соответствии с уравнениями электродных реакций [1, 2]:
- на положительном электроде
РbО2+2e + 2SO42- + 4H+ → PbSO4 + 2Н2О + SO42-, (2)
- на отрицательном электроде
Рb – 2e + 2H+ + SO42- → PbSO4 + 2Н+. (3)
Количество активных веществ электродов и электролита, участвующих в токообразующей химической реакции, пропорционально количеству электричества, прошедшему через аккумулятор при его разряде или заряде, и подчиняется законам Фарадея. При этом в электролите наблюдается направленное движение катионов и анионов под действием электрического поля между электродами.
Согласно этим законам [1, 2, 3] превращение одного грамм-эквивален-та активного вещества, участвующего в токообразующей химической реакции, происходит при протекании одного и того же количества электричества, равного 96 500 Кл. Причем это количество электричества эквивалентно емкости, равной 26,8 А∙ч.
Грамм-эквивалент активного вещества равен атомному весу ионов, участвующих в токообразующих электродных реакциях, деленному на величину зарядов этих ионов.
Так как атомный вес свинца равен 207,2 г, а его валентность (величина заряда иона) в реакции на отрицательном электроде (Рb2+) равна 2, то масса одного грамм-эквивалента свинца составит 207,2 /2 = 103,6 г. Отсюда вычисляем количество грамм свинца, перешедших в сульфат свинца (PbSO4) при отданной аккумулятором емкости, равной 1 А∙ч: 103,6/26,8 = 3,866 г/(А∙ч).
В токообразующей химической реакции как у отрицательного, так и у положительного электродов участвуют две молекулы серной кислоты, в связи с чем масса одного ее грамм-эквивалента будет равна: 2∙(32 + 16∙4 + 2∙1)/2 = 98 г.
Отсюда следует, что для получения 1 А∙ч электричества при разряде аккумулятора согласно токообразующей реакции (1) требуется масса кислоты, равная 98/26,8 = 3,66 (г/А∙ч).
Аналогичным образом рассчитывается количество остальных участвующих в токообразующей реакции активных веществ. При протекании токообразующей реакции между электродами свинцового аккумулятора согласно уравнению (1) для получения количества электричества, эквивалентного емкости в 1 А∙ч, расход активных веществ составит:
- свинца (Pb) – 3,866 г/(А∙ч);
- серной кислоты (H2SO4) – 3,66 г/(А∙ч);
- двуокиси свинца (PbО2) – 4,46 г/(А∙ч).
При этом образуется:
- воды (H2O) – 0,67 г/(А∙ч);
- сульфата свинца (PbSO4) – 11,6 г/(А∙ч).
Электродные реакции (2) и (3) при разряде аккумулятора обусловливают токообразующий процесс в нем, сопровождающийся электрическим током как во внешней цепи, так и в электролите.
Так, при замыкании внешней цепи под действием ЭДС аккумулятора в ней потечет электрический ток по направлению от положительного электрода к отрицательному, а электроны, накопившиеся на отрицательном электроде, будут перетекать по внешней цепи в противоположном направлении.
При этом электрический ток в электролите будет обусловлен направленным движением положительно и отрицательно заряженных ионов электролита под действием приложенного к нему электрического поля.
Согласно токообразующему процессу теории «двойной сульфатации» электрический ток в электролите будут обеспечивать в одном и том же электрическом поле:
- положительно заряженные ионы водорода Н+, перемещающиеся к положительному электроду;
- отрицательно заряженные ионы SO42-,
одновременно перемещающиеся как к положительному, так и к отрицательному электродам.
Это противоречит существующим представлениям о протекании тока в электролите и нарушает сопряженность электродных реакций.
Таким образом, механизм токообразующей реакции (1) согласно теории «двойной сульфатации» противоречит законам протекания тока в электролите и требует уточнения.
Теория «двойной сульфатации» предполагает поверхностный механизм протекания токообразующей химической реакции при работе аккумулятора. Учитывая, что в результате протекания токообразующей химической реакции на обоих электродах образуется сульфат свинца, для подтверждения ее состоятельности необходимо оценить величину полной поверхности аккумуляторных электродов по критерию возможности размещения на ней продуктов (PbSO4) токообразующей химической реакции полностью разряженного аккумулятора.
Известно, что пористость аккумуляторных электродов составляет приблизительно 50 − 56% от объема активной массы положительного электрода и 65 – 67% от объема активной массы отрицательного электрода, при этом диаметр пор активной массы положительного электрода в среднем составляет
(1−2) мкм, а отрицательного электрода – (8−10) мкм [4, 5].
Из работы [6] следует, что такую пористость можно смоделировать в пористом теле из шаров, расположенных в кубической симметрии
(рисунок 1).
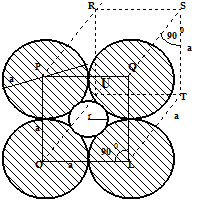
L, O, P, Q, R, S, T, U − центры сферических частиц ячейки пористого тела;
а − диаметры сферических частиц; r − радиус сферы, вписанной между
сферическими частицами пористого тела
Рисунок 1 − Кубическая укладка сферических частиц при образовании
ячейки пористого тела
В этом случае объемную пористость электрода (γ) можно определить из выражения [5]
γ = Vпор / Vам, (4)
где Vпор – объем пор в активной массе электрода, см3;
Vам – объем активной массы электрода с учетом пор (полный объем электрода), см3.
При кубической модели укладки активных элементов в активной массе активная поверхность электрода будет определяться суммой поверхностей шаров, диаметр которых D равен диаметру элементарных частиц, составляющих активную массу. Тогда площадь элементарной частицы Sед определяется из выражения
Sед = πD2, (5)
а занимаемый ею объем Vед кубического пространства внутри активной массы составит
Vед= D3. (6)
Количество элементарных частиц nуд , расположенных в объеме кубического пространства Vуд= 1см3,
можно определить по зависимости
nуд =Vуд / Vед = Vуд / D3. (7)
В этом случае площадь активной поверхности Sуд в удельном объеме активной массы составит
Sуд= Sед∙ nуд= n D2 . Vуд/D3= π ∙ Vуд / D = π / D. (8)
Занимаемый элементарными частицами объем V׳ам в удельном объеме активной массы Vуд (равном 1 см3) можно рассчитать по зависимости
V ‘ам = nуд . V ‘ед = Vуд π D3/ 6Vед = Vуд π D3 /6 D3 = π/6, (9)
где V ‘ед – фактический объем, занимаемый элементарной частицей в активной массе электрода, см3.
Тогда
Vпор = Vуд –V ‘ам , (10)
а γ = (Vуд –V ‘ам)/Vуд =1 –V ‘ам /Vуд или γ = 1– π /6 = (1 – 0,52) = 0,48.
Таким образом, выполненные расчеты показали, что при кубической укладке элементарных частиц, составляющих активную массу пористого тела, независимо от их размера пористость тела соответствует приблизительно 50%. Такая геометрическая модель позволяет получить площадь поверхности пористого материала с известным размером пор и значением пористости, близким к его эмпирически определенному значению.
Для выбранной модели строения активной массы электродов аккумулятора (рисунок 1) диаметр пор в узком месте (сечении) между элементарными частицами пасты будет определяться зависимостью [6] dпор ≈ 0,42 D , а в наиболее широком сечении − dпор ≈ 0,73 D.
Данная зависимость позволяет по известной величине dпор
рассчитать диаметр элементарных частиц активной массы D и определить полную площадь активной поверхности электрода Sэл
Sэл = Sуд · Vэл = πVэл / D, (см2). (11)
Объем электрода аккумулятора рассчитывается, исходя из его геометрических размеров
Vэл = ℓ · h · b, (см3), (22)
где ℓ , h , b – соответственно ширина, высота и толщина электрода, см.
Известно, что диаметр пор сформированных положительных электродов аккумулятора составляет d+пор=(1–16) мкм, а отрицательных электродов d−пор=(8–20) мкм [7, 8]. Вместе с тем в литературе при проведении расчетов чаще используются значения d+пор=(1–4) мкм и d−пор=(4–10) мкм.
Используя приведенные выше зависимости, представляется возможным рассчитать величину площади полной активной поверхности электродов S аккумулятора.
На рисунке 2 представлены расчетные зависимости изменения полной площади активной поверхности полублоков электродов аккумуляторной батареи 6СТ-75 от диаметра пор активной массы, полученные при следующих исходных данных [9]: ℓ= 14,3 см.; h = 13,35 см, b+ = 0,23 см, b− = 0,19 см, число электродов в полублоке n+ = 5, n− = 6, D ≈ dпор/0,73.
Анализ зависимостей показывает, что величина площади активной поверхности аккумуляторных электродов возрастает при уменьшении диаметра пор. При этом величина площади полной активной поверхности активной массы полублока положительных электродов аккумуляторной батареи 6СТ-75 может составить от 1,25∙106 до 5∙106 см2, а полублока отрицательных электродов − от 0,5∙106 до 1,25∙106 см2 в установленном для них диапазоне изменения диаметра пор.
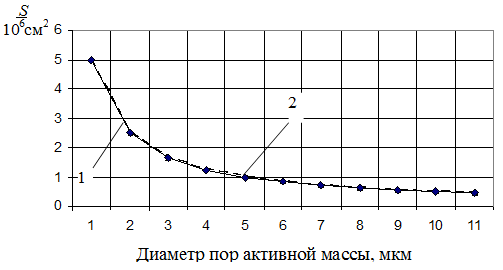
1 – полублок положительных электродов;
2 – полублок отрицательных электродов
Рисунок 2 –
Зависимость полной площади активной поверхности
полублока электродов от диаметра пор активной массы
Так как в соответствии с теорией «двойной сульфатации» токообразующая химическая реакция в свинцовом кислотном аккумуляторе протекает на поверхности активной массы электродов и при этом продуктом реакции при разряде аккумулятора на обоих электродах является сульфат свинца. Таким образом, по количеству образовавшегося на электродах сульфата свинца можно судить о величине отдаваемой аккумулятором емкости.
Для количественной оценки отдаваемой аккумулятором емкости в качестве расчетной используем модель сплошной монослойной пленки сульфата свинца на поверхности его электродов [2, 8], структурная схема которой представлена на рисунке 3.
Модель предполагает формирование при разряде аккумулятора на его электродах поверхностного монослоя из сульфатов свинца с ориентированными плотноупакованными молекулами.
При работе аккумулятора согласно общепринятой теории «двойной сульфатации» определяющую роль играет контакт реагентов непосредственно на границе «электролит − активная масса электрода», так как протекание реакций заряда и разряда, саморазряда через слой сульфата свинца маловероятны. В связи с этим, оценив концентрацию серы на поверхности активной массы электродов аккумулятора, можно сделать заключение о величине отданной аккумулятором емкости.
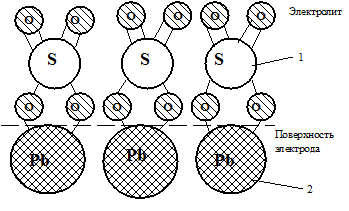
1 − радикалы 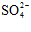 ; 2 − атомы свинца
; 2 − атомы свинца
Рисунок 3 − Модель сплошной монослойной пленки сульфата
свинца на поверхности электродов
Оценку поверхностной концентрации серы можно выполнить несколькими способами [10]:
- рассчитав величину заряда атомов серы, которые должны разместиться в монослойной пленке сульфата свинца на поверхности электродов аккумулятора при его разряде на 1 А∙ч, – электронная модель;
- рассчитав массу атомов серы, которые должны разместиться в монослойной пленке сульфата свинца на поверхности электродов аккумулятора при его разряде на 1А∙ч, – массовая модель;
- рассчитав величину отдаваемой емкости аккумулятором при условии образования сплошной монослойной пленки сульфата свинца на поверхности электродов аккумулятора – модель сплошного слоя.
Проведем оценку поверхностной концентрации атомов серы на электродах аккумулятора 6СТ-75, используя электронную модель.
Расчёт количества атомов серы выполним для режима разряда аккумулятора при условии, что при его разряде по механизму теории «двойной сульфатации» на поверхности отрицательного электрода адсорбируется атом серы при отборе заряда, равного 2е [11], а на положительном электроде атом серы адсорбируется при приеме двух электронов свинцом диоксида его активной массы. Причем обе протекающие при этом электродные реакции являются сопряженными [12], а величины электрических зарядов, реализуемых на каждом из них, равны.
Полагая поверхностный монослойный механизм протекания токообразующей химической реакции на электродах, можно ожидать, что отдаваемая аккумулятором емкость будет ограничена величиной общей площади активной поверхности активной массы его электродов. В этом случае, рассчитав количество электронов, участвующих в переносе заряда на каждом электроде при отборе у аккумулятора емкости в 1 А∙ч, можно рассчитать количество атомов серы и их поверхностную концентрацию на электродах.
При отборе заряда в 1 А×ч количество отданных электродом электронов ne
определится из соотношения [13]
ne = I×t/e, (13)
где I − ток разряда, А;
t − время разряда (саморазряда), с;
е − величина заряда электрона, 1,6×10-19 Кл.
Тогда в переносе заряда между электродами величиной 1 А×ч будут участвовать электроны в количестве
ne=1×3600/1,6×10-19=2,25×1022.
В токообразующей химической реакции на электродах аккумулятора участвуют по два электрона каждого атома серы, в связи с чем общее количество атомов серы определим из выражения
ns =ne /2 = 2,25×1022/2 = 1,125∙1022 .
В этом случае удельная концентрация атомов серы (на 1 см2) n0S при их диаметре ds
»3Å составит nоs»1,1×1015.
Тогда при разряде аккумулятора на величину ΔС = 1 А×ч атомы серы могут закрыть сплошным монослоем на каждом из полублоков электродов поверхность площадью
SSуд = ns/nоs = 10,2∙106 см2.
Применительно к аккумуляторной батарее 6СТ-75, площадь поверхности и положительного и отрицательного полублоков электродов которой меньше площади SSуд , это означает, что уже при ее разряде на величину 1 А×ч поверхность полублока положительных электродов покроется приблизительно двумя монослоями, а отрицательных электродов – восемью монослоями атомов серы.
Но согласно теории «двойной сульфатации» протекание зарядоообразования и разряда предполагается при прямом электронном взаимодействии свинца и радикалов SO4 2− [14]. При наличии буферного слоя серы второй и последующие за ним слои диоксида свинца активной массы положительного электрода (на отрицательном электроде − свинца) в прямое взаимодействие с радикалами серной кислоты в электролите не вступают. А это значит, что в этом случае состояние аккумулятора практически будет соответствовать полному его разряду.
Результаты расчетов [10], выполненных для оценки поверхностной концентрации серы на электродах аккумулятора 6СТ-75 при реализации в нем токообразующего процесса по механизму «двойной сульфатации» с использованием «массовой модели» и «модели сплошного слоя», согласуются с результатами, полученными при расчетах с использованием «электронной модели». Во всех случаях при разряде в 1 А×ч поверхность отрицательного полублока электродов должна покрываться не менее чем 8, а положительного полублока электродов – не менее чем 2 монослоями сульфата.
Выполненные расчеты позволяют предположить: так как монослойный процесс сульфатации не обеспечивает получение ожидаемой величины отдаваемой свинцовым аккумулятором емкости, то образование заряда обусловлено не только поверхностными процессами, но и объемными. При этом могут рассматриваться несколько вариантов, обеспечивающих фактическую ёмкость аккумуляторов при монослойном процессе сульфатации:
- ёмкость аккумулятора обеспечивается поверхностными процессами, но не одноразовой, а многоразовой сульфатацией за цикл «разряд – заряд», то есть «челночными» переходами кластеров SO4 2− границы «электролит − поверхность электрода» с переносом заряда в одну сторону;
- микрокристаллы активной массы имеют более тонкую микроструктуру, которая обеспечивает более развитую поверхность, чем активная масса с зерном в 2,75 мкм;
- механизм токообразующих реакций в реальном аккумуляторе отличается от механизма, предлагаемого теорией «двойной сульфатации».
Полученная при расчётах интенсивность сульфатации электродов свинцового аккумулятора при его разряде оказывается слишком высокой, что свидетельствует о том, что поверхностный процесс зарядообразования, протекающий согласно общепринятой теории «двойной сульфатации»
не обеспечивает фактическую ёмкость реального аккумулятора.
Это означает, что в случае протекания реакций разряда в свинцовом аккумуляторе в соответствии с теорией «двойной сульфатации» при снижении емкости на величину, не более 1% от фактической, происходил бы его полный разряд.
Следовательно, теория «двойной сульфатации» не полностью объясняет протекание процессов зарядо- и токообразования, саморазряда в свинцовом кислотном аккумуляторе.
Таким образом, проведённый расчёт площади сульфатированной поверхности полублоков аккумуляторных электродов поднимает ряд вопросов, для решения которых необходима постановка физических экспериментов.
Во-первых, необходимо экспериментально определить наличие серы и её количество, образующееся на поверхности активной массы электродов при разряде аккумулятора.
Во-вторых, исследовать поведение свинца и двуокиси свинца в составе активной массы электродов аккумулятора и изменения в их элементном составе при циклировании.
Так как процессы зарядообразования согласно общепринятой физико-химической модели работы свинцового аккумулятора происходят на монослойном уровне, то необходимо выполнить физические эксперименты по определению элементного состава поверхности электродов, используя приборы с чувствительностью к монослою поверхности [15].
Библиографический список
- Дасоян, М.А. Современная теория свинцового аккумулятора [Текст] / М.А. Дасоян, И.А. Агуф. − Л.: «Энергия», 1975. − 312 с.
- Скорчеллетти, В.В. Теоретическая электрохимия [Текст] / В.В. Скорчеллетти. – М.: «Химия», 1969. – 608 с.
- Ипполитов, Е.Г. Физическая химия [Текст]: учебник для студ. высш. учеб. заведений / Е. Г. Ипполитов, А. В. Артемов, В. В. Батраков; под общ. ред. Е. Г. Ипполитова. – М.: Издательский центр «Академия», 2005. – 448 с.
- Болотовский, В.И. Эксплуатация, обслуживание и ремонт свинцовых аккумуляторов [Текст] / В.И. Болотовский, З.И. Вайсгант. − Л.: Энергоатомиздат. Ленингр. отд-ние, 1988. − 208 с.
- Дасоян, М.А. Основы расчета, конструирования и технологии производства свинцовых аккумуляторов [Текст] / М.А. Дасоян, И.А. Агуф. – Л.: Энергия, 1978. 152 с.
- Кошолкин, В.Н. Распределение тока в аккумуляторах [Текст] / В.Н. Кошолкин, О.С. Ксенжек // Исследования в области химических источников тока: сб. науч. тр. / Саратовский университет. – 1971. – С. 43–57.
- Ютт, В.Е. Электрооборудование автомобилей [Текст]: учебник для автодор. вузов / В.Е. Ютт. – М.: Транспорт, 1989. – 287 с.
- Мелвил-Хьюз, Э.А. Физическая химия [Текст]. Кн.2. /
- Э.А. Мелвил-Хьюз. – М.: Наука, 1962. – 807 с.
- Свинцовые стартерные аккумуляторные батареи [Текст]: руководство. – М.: Воениздат, 1983. – 170 с.
- Гумелев В.Ю. Рациональный режим хранения свинцовых стартерных батарей, основанный на результатах исследования процессов старения их аккумуляторов [Текст]: дис. … канд. техн. наук : 20.02.17 : защищена 01.06.01 : утв. 20.07.01 / Гумелев Василий Юрьевич. – Рязань, 2001. – 257 с. – Библиогр.: С. 248–257.
- Аккумуляторные батареи [Текст] / под ред. П.И. Устинова. – М. –Л.: Госэнергоиздат, 1952. – 462 с.
- Багоцкий, В.С. Химические источники тока [Текст] / В.С. Багоцкий, А.М. Скундин. − М.: Энергоиздат, 1981. − 360 c.
- Лыков, А.В. Тепломассообмен [Текст]: справочник / А.В. Лыков. – М.: Энергия, 1978. – 480 с.
- Гиббс, Дж. Термодинамические работы [Текст] / Дж. Гиббс. – М. – Л.: Госэнергоиздат, 1950. – 556 с.
- Кочуров А.А. Результаты экспериментального исследования элементного состава активной массы электродов свинцового аккумулятора [Текст] / А.А. Кочуров // Научно-педагогическая деятельность профессорско-преподавательского состава на пути развития образования в высшем военно-техническом учебном заведении: сб. статей. – М.: Компания Спутник+, 2006. – С. 45–51.