В работах [1, 2] показано, что железомарганцевые конкреции (ЖМК) являются перспективным природным сорбентом для очистки природных и артезианских вод, используемых для питьевого водоснабжения, а также сточных вод и сбросных технологических растворов.
Для прогнозирования условий извлечения и разделения катионов необходима количественная характеристика их сорбционной способности. В качестве таковой обычно используют значения предельной сорбции (емкости) ионита по данному виду катионов. В работе [3] катионы по значениям емкости расположены в следующий ряд сорбционной способности на поверхности ЖМК:
|
ЖМК
|
Na
|
<
|
Cd
|
<
|
Sr
|
<
|
Co
|
<
|
Ni
|
<
|
Zn
|
<
|
Cu
|
|
Емкость, мг-экв/г
|
0,95
|
1,15
|
1,46
|
1,91
|
2,06
|
2,07
|
2,21
|
Однако емкость зависит как от сродства катионов к иониту, так и от геометрических факторов: «посадочной площадки» катионов, удельной поверхности ионита и концентрации ионообменных групп. Вытеснительная способность катионов, обуславливающая избирательность сорбции, определяется химическим сродством, количественно характеризуемым энергией Гиббса ионного обмена. Поэтому актуально построение рядов вытеснительной способности катионов (лиотропных рядов) на основе значений энергий Гиббса процесса и выявление корреляционных зависимостей между свойствами катионов и термодинамическими функциями ионного обмена.
Изотерму обмена ионов натрия и кобальта изучали на поверхности ЖМК Финского залива.
В таблице 1 приведен основной химический состав конкреций Копорского залива, определенный нами рентгенофлуоресцентным методом, в сравнении с составом, приведенным в работе [1].
Таблица 1 Химический состав конкреций Копорской губы Финского залива
|
Компонент
|
Содержание, масc %, определенное рентгенофлуорес-центным методом
|
Среднее содержание, масс %, определенное в работе [1]
|
|
Общий Mn в расчете на MnO2
|
35,87
|
33,80
|
|
Fe2O3
|
36,23
|
20,19
|
|
Sr
|
0,263
|
0,0027
|
|
Cu
|
0,339
|
0,0034
|
|
Pb
|
0,449
|
0,0034
|
|
Zn
|
0,074
|
0,0057
|
|
Со
|
0,0067
|
0,0030 – 0,0120
|
|
Ni
|
0?0134
|
0,0010 – 0,500
|
|
SiO2
|
-
|
17,87
|
|
Al2O3
|
-
|
4,49
|
|
P2O5
|
-
|
2,70
|
Природные образцы железомарганцевых конкреций содержат различные обменные катионы, поэтому ЖМК перед опытами были переведены в натриевую форму, так как ионы натрия наиболее легко вытесняются другими катионами [2].
Ионный обмен изучали из модельных водных растворов Co(NO3)2 с концентрацией по катиону Co2+ 0,05 – 1,26 моль·кг-1 при температуре 298 К. Величину сорбции Г (моль·кг-1) катионов кобальта определяли в статических условиях при отношении объема жидкой фазы к массе твердой V/m=10 дм3·кг-1 и массе навески ЖМК 5 г по разности концентраций исходного С0 и равновесного Сррастворов по формуле:
![]() , (1)
, (1)
где с – плотность раствора в кг·дм-3.
Раствор нитрата кобальта перемешивали с навеской ЖМК до равновесного состояния. Время установления равновесия, отвечающего постоянству концентрации раствора, составляло 5-6 ч., в опытах время контакта фаз устанавливали не менее 10 ч.
На рисунке 1 приведена изотерма сорбции катионов Co2+ на поверхности ЖМК на основании данных таблицы 2, содержащей значения исходных и равновесных концентраций катионов Co2+ С0 иСр; величины сорбции катионов Co2+ Г; обратные величины сорбции катионов Co2+ 1/Г; равновесные концентрации ионов натрия СNa+ и средние ионные коэффициенты активности г± NaNO3 иCo(NO3)2, взятые из табличных данных [7].
Таблица 2 Результаты опытов по ионному обмену Co2+ на Na+
|
С0,
молькг-1 |
Ср,
молькг-1 |
Г, молькг-1
|
1/Г,
моль-1 кг |
г±
NaNO3 |
г±
Co(NO3)2 |
СNa+, молькг-1
|
|
0,050
|
0,002
|
0,486
|
2,058
|
0,765
|
0,549
|
0,097
|
|
0,069
|
0,016
|
0,532
|
1,880
|
0,726
|
0,541
|
0,106
|
|
0,075
|
0,020
|
0,542
|
1,845
|
0,716
|
0,538
|
0,108
|
|
0,101
|
0,044
|
0,568
|
1,761
|
0,681
|
0,527
|
0,114
|
|
0,126
|
0,068
|
0,580
|
1,724
|
0,655
|
0,515
|
0,116
|
|
0,141
|
0,081
|
0,600
|
1,667
|
0,643
|
0,508
|
0,120
|
|
0,170
|
0,109
|
0,610
|
1,639
|
0,623
|
0,495
|
0,122
|
|
0,204
|
0,142
|
0,620
|
1,613
|
0,603
|
0,479
|
0,124
|
|
0,401
|
0,337
|
0,643
|
1,555
|
0,533
|
0,455
|
0,129
|
|
0,803
|
0,738
|
0,650
|
1,538
|
0,464
|
0,470
|
0,130
|
|
1,260
|
1,194
|
0,660
|
1,515
|
0,420
|
0,546
|
0,132
|
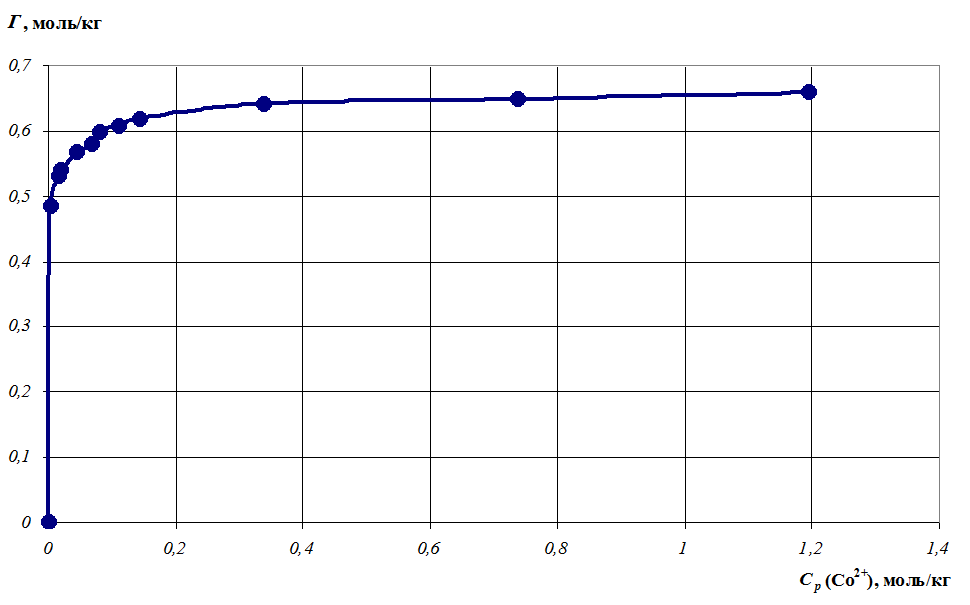
Рисунок 1
Изотерма сорбции на поверхности ЖМК
Термодинамическое описание обмена ионов кобальта (2+) и натрия было проведено при допущении идеальности твердой фазы, т.е. без учета коэффициентов активности ионов в сорбированном состоянии. Использовали метод линеаризации модифицированного уравнения закона действующих масс для реакции ионного обмена:
имеет вид: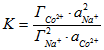 , (1)где К – кажущаяся константа обмена,
, (1)где К – кажущаяся константа обмена, ![]() и
и ![]() – величины сорбции ионов (моль·кг-1),
– величины сорбции ионов (моль·кг-1), ![]() и
и ![]() - активности ионов в растворе, (в уравнение закона действующих масс значения активностей подставляются в моль•кг-1 и относятся к активности в стандартном состоянии 1 моль•кг-1, так что в итоге активности безразмерны).
- активности ионов в растворе, (в уравнение закона действующих масс значения активностей подставляются в моль•кг-1 и относятся к активности в стандартном состоянии 1 моль•кг-1, так что в итоге активности безразмерны).
Значение предельной сорбции ионов равно:
![]() ,
,
где ![]() - величина предельной сорбции ионов в моль Co2+·кг-1, значения сорбции ионов выражены в моль·кг-1. Уравнение (1) может быть приведено к виду:
- величина предельной сорбции ионов в моль Co2+·кг-1, значения сорбции ионов выражены в моль·кг-1. Уравнение (1) может быть приведено к виду:
.gif) (2)
(2)
Уравнение (2) преобразовали в формулу (3),
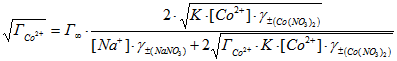 (3)
(3)
Линейная форма уравнения имеет вид:
.gif) , (4)
, (4)
Зависимость обратной величины сорбции ионов кобальта ![]() от аргумента
от аргумента 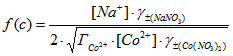 , представленная на рисунке 2, аппроксимируется линейным уравнением:
, представленная на рисунке 2, аппроксимируется линейным уравнением:
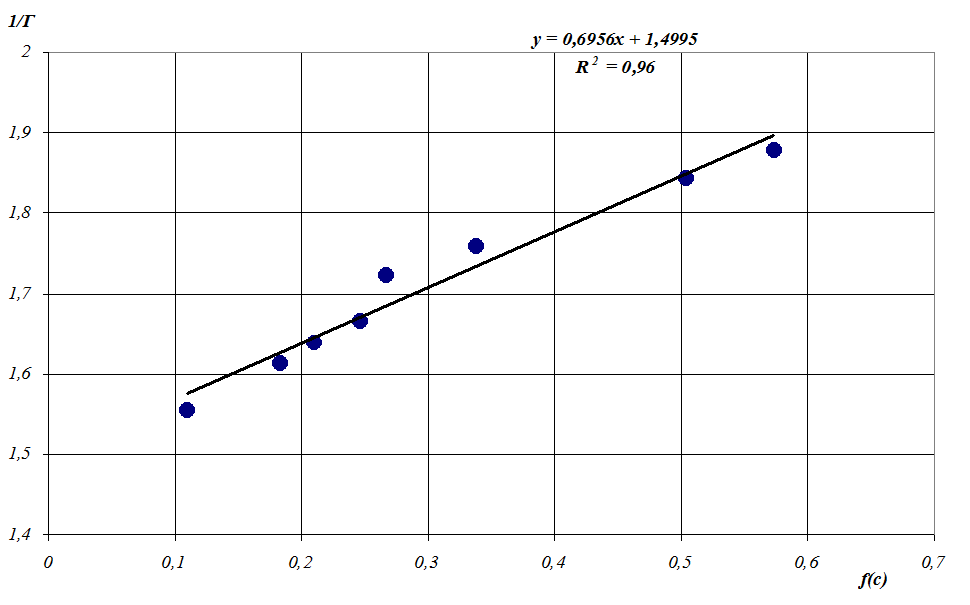
Рисунок 2
Линейная форма изотермы сорбции
![]() с достоверностью аппроксимации R2 = 0,96.
с достоверностью аппроксимации R2 = 0,96.
Для построения данной зависимости были использованы значения отвечающие области Лэнгмюра на изотерме, то есть три точки, лежащие на рисунке 1 в области предельной сорбции, не учитывались.
Отсюда вычислены значение предельной сорбции ионов Co2+ ![]() 0,667 моль·кг-1. Кажущуюся константу ионного обмена вычислили по формуле:
0,667 моль·кг-1. Кажущуюся константу ионного обмена вычислили по формуле:
Диференциальная энергия Гиббса обмена катионов кобальта на катионы натрия на поверхности ЖМК составила ![]() –3,81 кДж·моль-1.
–3,81 кДж·моль-1.
Значение предельной сорбции катионов стронция на поверхности ЖМК составляет ![]() 0,485 моль·кг-1 [4], что в 1,37 раз меньше предельной сорбции катионов кобальта. Очевидно это связано с меньшей величиной посадочной площадки ионов Co2+. По величине удельной поверхности ЖМК Sуд = 43,81 м2·г-1 [8] и предельной сорбции катионов кобальта 0,667 молькг-1 оценили «посадочную площадку» ионов:
0,485 моль·кг-1 [4], что в 1,37 раз меньше предельной сорбции катионов кобальта. Очевидно это связано с меньшей величиной посадочной площадки ионов Co2+. По величине удельной поверхности ЖМК Sуд = 43,81 м2·г-1 [8] и предельной сорбции катионов кобальта 0,667 молькг-1 оценили «посадочную площадку» ионов:
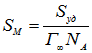 =
=![]() м2, где NA – число Авогадро.
м2, где NA – число Авогадро.
Отсюда радиус сорбированного катиона Co2+ равен 186 пм. Данное значение больше значения кристаллографического радиуса катиона Co2+ по Бокию (78 пм) [7] и меньше значения радиуса гидратированного катиона 304 пм вычисленного по уравнению Стокса.
![]() , (6)
, (6)
где ![]() - заряд катиона кобальта, F – постоянная Фарадея, з – вязкость воды,
- заряд катиона кобальта, F – постоянная Фарадея, з – вязкость воды, ![]() - предельная эквивалентная электропроводность катиона кобальта.
- предельная эквивалентная электропроводность катиона кобальта.
Экспериментально определенный радиус катиона Co2+ следует рассматривать как средний эффективный радиус частично дегидратированных ионов.
Полученное значение радиуса катиона Co2+aq, сорбированного на поверхности ЖМК, меньше радиуса сорбированного катиона Sr2+aq (213 пм) [4], вследствие большей степени дегидратации.
Степень дегидратации сорбированных катионов можно охарактеризовать количественно следующей формулой:
где ![]() – радиус гидратированного катиона по Стоксу,
– радиус гидратированного катиона по Стоксу, ![]() – полученный радиус катиона в сорбированном состоянии,
– полученный радиус катиона в сорбированном состоянии, ![]() – кристаллографический радиус. Степень дигидротации сорбированного катиона Co2+ 52% больше таковой у сорбированного катиона Sr2+ 40%.
– кристаллографический радиус. Степень дигидротации сорбированного катиона Co2+ 52% больше таковой у сорбированного катиона Sr2+ 40%.
Выводы
1. Изотерма ионного обмена катионов Co2+ и Na+ на ЖМК описывается методом линеаризации модифицированного уравнения закона действующих масс.
2. Определены кажущаяся константа ионного обмена К = 4,65 и дифференциальная энергия Гиббса обмена ионов кобальта на ионы натрия на поверхности ЖМК ![]() кДж·моль-1. Оценена посадочная площадка катионов кобальта, равная 10,9·10-20 м2, значение радиуса сорбированного иона – 186 пм, свидетельствует о его частичной дегидратации.
кДж·моль-1. Оценена посадочная площадка катионов кобальта, равная 10,9·10-20 м2, значение радиуса сорбированного иона – 186 пм, свидетельствует о его частичной дегидратации.
Библиографический список
- Зарицкий В.П. // Конкреции и конкреционный анализ: Сб. статей. М.: Наука, 1977, С 84-79.
- Челищев Н.Ф. Сорбционные свойства океанических железомарганцевых конкреций и корок. М.: Недра, 1992, 316 с.
- Новиков Г.В., Сироткина И.В // Сорбционный механизм формирования химического состава океанских железомарганцевых рудных отложений. Вестник отделения наук о Земле РАН – №1(22)′2004
- Чиркст Д Э, Черемисина О В, Иванов М В, Чистяков АА, Жадовский И Т // Изотерма обмена катионов никеля и натрия на ЖМК. Журнал прикладной химии. 2006. Т.79, Вып.7 с. 1101 – 1105
- Чиркст Д Э, Черемисина О В, Иванов М В, Чистяков АА, Жадовский И Т. // Изотерма обмена катионов Sr и Na на ЖМК. Журнал прикладной химии. 2006. Т.79, Вып.3 с. 374 – 377
- Лурье Ю.Ю. Унифицированные методы анализа вод. М.: Химия, 1971, 446 с.
- Краткий справочник физико-химических величин./ Под ред. А.А. Равделя и А.М. Пономаревой. Л.: Химия. 2002, С. 123, 130, 200, С. 231 с.
- Чиркст Д.Э., Черемисина О.В., Иванов М.И., Чистяков А.А. // Сорбция железа (2+) железомарганцевыми конкрециями. ЖПХ. 2005. Т.78. № 4. С. 599-605.