Термические поражения представляют серьезную медицинскую, социальную и экономическую проблему. Ежегодно в России их регистрируют 500-560 тысяч, что составляет до 8% в общей структуре травматизма населения страны [1]. Показатель общей летальности от ожоговой травмы в Российской Федерации достигает 6,1%. В общей структуре летальности удельный вес ожогов среди прочих видов травм достигает 8%. В последнее десятилетие данный показатель не имеет тенденции к снижению.
Термическая травма сопровождается развитием эндогенной интоксикации, которая сопровождается накоплением в крови токсичных биологически активных компонентов в результате усиления катаболических процессов при снижении эндогенной детоксикации. В частности, увеличивается содержание таких промежуточных метаболитов, как альдегиды [2], которые в повышенных концентрациях вызывают ряд отрицательных эффектов. Процессы генерализации токсичных среднецепочечных альдегидов усиливаются при термической травме в результате ускорения липидной пероксидации.
Основная роль в процессе детоксикации и выведения токсичных соединений отводится ферментным системам печени и почек. Энзиматический барьер реализуется в ходе реакций окисления и восстановления, метилирования, ацетилирования, различных синтезов. Утилизация альдегидов протекает преимущественно при участии таких ферментов системы биотрансформации как альдегиддегидрогеназа и алкогольдегидрогеназа [3].
Термическая травма приводит к нарушению функции почек, что проявляется развитием нефропатий. Поражение почек проявляется развитием острой почечной недостаточности. При этом клинически отмечается снижение диуреза (вплоть до анурии), протеинурия, гематурия, нарастание в сыворотке крови мочевины и креатинина,протеинурия, появление свободного гемоглобина в моче и различного вида цилиндров в осадке. В литературе есть данные о наличии латентно протекающих почечных нарушениях у больных с ожогами [4].
Таким образом, исследование активности альдегиддегидрогеназы и алкогольдегидрогеназы в почках является актуальным в решении проблемы эндогенной интоксикации при ожоге.
Целью данной работы явилось исследование активности альдегиддегидрогеназы и алкогольдегидрогеназы в почках крыс с термической травмой.
Материалы и методы. В эксперименте использованы белые крысы – самцы линии Wistar (Столбовая, Москва, Россия) массой 180-250 г., содержавшиеся на стандартном рационе вивария и имевшие свободный доступ к воде. Животные были разделены на две группы: контрольную – (интактные крысы, n=10) и опытную – (крысы с ожогом, n=10). Животным опытной группы под комбинированным наркозом (золетил+ксила) наносили ожог кипятком на депелированную поверхность спины (20%), экспозиция – 3 с. [5]. Крыс выводили из эксперимента на третьи, седьмые и десятые сутки после травмы путем декапитации под наркозом. Для исследований использовали 10%- ый гомогенат почек на основе среды, содержащей0,25 М раствор сахарозы,0,01 М трис-HCl-буфер (рН=7,5) (1000 g, 10 мин, t=0 + 2°С) [6]. Активность альдегиддегидрогеназы определяли по методу Б. М. Кершенгольц, Л. П. Ильиной с 5мМ ацетальдегидом в качестве субстрата по наработке НАДН [4]. Активность АДГ определяли с использованием в качестве субстрата этилового спирта (прямая реакция, АДГпр) и ацетальдегида (обратная реакция, АДГобр) по методу W. M. Keung et al. (1989) [7]. Концентрацию белка вычисляли по методу Лоури в модификации [8]. Результаты исследований обрабатывали с использованием t-критерия Стьюдента [9]. Обработку данных осуществляли на компьютере с помощью программы BIOSTAT. При расчете t-критерия Стьюдента применяли поправку Бонферрони, позволяющую устранить ошибку первого рода, возникающую при сравнении более чем двух выборок данным методом.
Результаты и их обсуждение.
Полученные результаты показали, что при ожоге общая активность АлДГ на 3 и 10 сутки после травмы в почках статистически значимо не отличается от активности фермента контрольной группы крыс, при этом выявлено снижение общей активности альдегиддегидрогеназы на 7 сутки после поражения (рисунок).
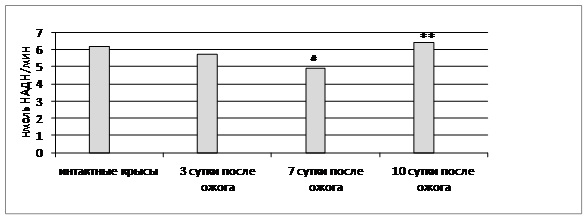
Рис. Общая активность альдегиддегидрогеназы в почках в норме и при ожоге
Примечания: # – статистически значимо по сравнению с контрольными крысами (р≤0,05); ** – статистически значимо по сравнению с ожогом (7 сутки).
Уменьшение активности АлДГ ведет к накоплению большого количества альдегидов, которые, в свою очередь, токсичны для организма обожженных крыс, и, ингибируя активность многих ферментов, снижают детоксикационную функцию почек, одного из органов нейтрализации ксенобиотиков [10]. Возможно, что понижение способности почек инактивировать токсические вещества при ожогах может быть одной из причин увеличения их количества в крови и способствовать развитию синдрома эндогенной интоксикации [4].
Удельная активность альдегиддегидрогеназы в почках статистически значимо возрастает на 3 сутки после ожога на 21,8% (р=0,0246), на 10 сутки после поражения на 45,5% (р=0,0123) по сравнению с активностью фермента контрольной группы животных (таблица). Следует отметить преобладание общей активности альдегиддегидрогеназы и повышение удельной активности фермента в почках во все исследуемые сутки поражения, что свидетельствует о возрастании детоксикационной функции данного органа.
Таблица. Удельная активность альдегиддегидрогеназы и алкогольдегидрогеназы (нмоль НАДН/мин×мг белка) в почках контрольных животных и крыс с ожогом
| Показатель | Контрольные
крысы |
Крысы с ожогом |
||
| 3 сутки | 7 сутки | 10 сутки | ||
| АлДГ | 80,50±5,55 | 98,04±6,71 # | 87,05±8,27 | 117,10±9,25 #/** |
| АДГпр | 15,25±1,04 | 32,61±2,85# | 29,29±1,27# | 49,48±1,14 #/*/** |
| АДГобр | 48,68±2,99 | 12,91±1,71# | 14,91±0,98# | 33,36±1,14#/*/** |
Примечания: # – статистически значимо по сравнению с контрольными крысами (р≤0,05); *-статистически значимо по сравнению с 3-ми сутками (р≤0,05); ** – статистически значимо по сравнению с ожогом (7 сутки) (р≤0,05) .
Показано, что в почках происходит падение активности АДГобр на 73,5% на 3-и сутки, на 69,4% на 7-е сутки, на 31,5% на 10-е сутки (таблица). В. А. Корячкин и др. (2002) высказали предположение, что нарушение функции почек при ожогах может иметь своей причиной воздействие токсических продуктов на их паренхиму и уменьшение притока крови к органу [11].
Уменьшение активности АДГобр, вероятно, связано с изменением физиологических особенностей организма после ожога, развитием полиорганной недостаточности, которая, по мнению М. Я. Малаховой, сопровождает ожоговую травму и, возможно, именно обратная реакция алкогольдегидрогеназы наиболее чувствительна к недостаточности кровоснабжения и гипоксии в органах, а также к эндогенной интоксикации организма [9]. Понижение активности АДГобр при термической травме приводит к накоплению во всех исследуемых органах высокотоксичных альдегидов, ацеталей и кетонов. В почках при ожоге при снижении активности АДГобр статистически значимо возрастает активность АДГпр.
Отмечено повышение удельной активности АДГпр в почках в 2,0 раза на 3-и сутки, в 1,9 и 3,2 раза на 7-е и 10-е сутки после термической травмы.
Вычисленное соотношение удельных активностей АДГпр/АДГобр у интактных крыс составило в почках – 0,31. Полученное значение меньше единицы говорит о преобладании обратной реакции [12]. При термической травме в почках на 3-и, 7-е и 10-е сутки после поражения данное соотношение выше показателя интактных крыс, что приводит к повышению высокотоксичных альдегидов.
Таким образом, проведенные исследования показали, что при термической травме в почках происходят изменения каталитических свойств ферментов биотрансформации, приводящие к развитию эндогенной интоксикации.
Библиографический список
- Крылов К.М. и др. Оказание медицинской помощи пострадавшим с тяжелой термической и комбинированной травмой на догоспитальном этапе // Скорая медицинская помощь, 2009. №2. С. 34-37.
- Кирпичева А.Г., Зимин Ю.В. Влияние молекул средней массы на альдегиддегидрогеназную систему печени и эритроцитов в эксперименте // Успехи современного естествознания. 2004. №4. С.21-23.
- Малахова М. Я. Эндогенная интоксикация как отражение компенсаторной перестройки обменных процессов в организме // Эфферентная терапия. 2000. Т. 6. № 4. С. 3—14.
- Шингаров Э.А. Клинико-лабораторная характеристика поражения почек у детей, перенесших ожоговую болезнь: дис … канд. мед. наук. Москва, 2009. 135 с.
- Болтовская В.В. Патоморфология раневого процесса в зоне глубокого ожога кожи в условиях применения низкоинтенсивного электромагнитного излучения. Автореф. дисс. … канд. мед. наук. Саратов: Саратовский государственный медицинский университет, 2006.
- Ещенко Н.Д. Методы биохимических исследований, Изд-во Ленинградского ун-та, Ленинград, 1982.
- Keung W. M., Ho Y. W., Fong W. P. Isolation and characterization of shrew liver alcohol dehydrogenase // Comp. Biochem. and Physiol. B. 1989. Vol. 93. № 1. pp. 169-173.
- Waterborg J.H., Matthews H.R. The electrophoretic elution of proteins from polyacrylamide gels // Methods Mol. Biol. 1994. №32. рр. 169-175. PMID: 7524939
- Гланц С. Медико-биологическая статистика (пер. с англ.). М.: Практика, 1999.
- Соловьева А.Г. Роль альдегиддегидрогеназы печени и эритроцитов в развитии ожоговой токсемии у крыс // Вестник Российской академии медицинский наук. 2009. №9. С.36-38.
- Корячкин В. А., Страшнов В. И., Чуфаров В. Н. Интенсивная терапия угрожающих состояний. СПб: Санкт-Петербург. мед. изд-во, 2002. 288 с.
- Зимин Ю.В., Соловьева А.Г. Регуляторная роль надмолекулярного комплекса алкогольдегидрогеназы и лактатдегидрогеназы митохондрий клетки // Бюллетень экспериментальной биологии и медицины. 2009. Т.148. №12. С.644-645
- Кершенгольц Б.М., Ильина Л.П. Биологические аспекты алкогольных патологий и наркоманий. Якутск: Издательство ЯГУ, 1998.
- Кирпичева А.Г., Зимин Ю.В. Влияние молекул средней массы на альдегиддегидрогеназную систему печени и эритроцитов в эксперименте // Успехи современного естествознания. 2004. №4. С.21-23.
- Малахова М. Я. Эндогенная интоксикация как отражение компенсаторной перестройки обменных процессов в организме // Эфферентная терапия. – 2000, Т. 6, № 4. С. 3—14.