Исследована возможность образования молекулярных комплексов тетрафторида германия с несколькими органическими растворителями применительно к организации процесса разделения изотопов германия методом химического обмена с термическим обращением потоков.
Введение
Применение комплексных соединений трифторида бора и тетрафторида кремния с органическими комплексообразователями – основа существующей, а, возможно, и будущей технологии разделения изотопов бора и кремния методом химического обмена с термическим (безреагентным) обращением потоков [1, 2, 4, 6, 7], основанной на реакции образования (диссоциации) молекулярных комплексов вида ЭFn×D, где ЭFn – молекула, например, BF3, SiF4; D – комплексообразователь (органический растворитель),
и реакции изотопного обмена в системе газ-жидкость
*ЭFn (газ) + ЭFn·D(ж) ↔ ЭFn (газ) + *ЭFn·D(ж) . (2)
К сожалению, аналогичные комплексные соединения германия, пригодные для той же цели, в литературе отсутствуют. Имеются немногочисленные сведения (например, [5, 8]), причем, относящиеся либо к переходным состояниям (реакции аллилирования альдегидов [5]), либо к расчетно-теоретическим данным комплексов GeF4·[(CH3)2N(CH2)2N(CH3)2], GeF4·(N(CH3)3), GeF4·(NCH3H2) кристаллической структуры [8]. Поэтому, задача настоящего исследования – изучение возможности образования молекулярных комплексов GeF4 c органическими веществами, существующими в газо-жидкостных системах и потенциально пригодных для организации противоточного процесса разделения изотопов германия.
Методика эксперимента
Для проведения исследований комплексообразования использована довольно простая установка, схема которой показана на рисунке 1. В ячейку, изготовленную из стекла, помещали известное количество (mD) предварительно подготовленного комплексообразователя, дегазировали его и насыщали газообразным тетрафторидом германия при постоянном перемешивании и заданном значении температуры Т = (295 ± 1) К. Измерение количества поглощенного GeF4 ( выполнено весовым методом с использованием электронных весов с дискретностью 1×10-2 г.
Эксперимент прекращали по достижении устойчивого плато на зависимости mGeF4 от времени насыщения (рисунок 2).
В качестве критерия комплексообразования использовано значение мольного отношения r, представляющее собой число молей GeF4 (nGeF4), поглощенных одним молем комплексообразователя D (nD)
где MGeF4 и MD – молярная масса тетрафторида германия и комплексообразователя соответственно.
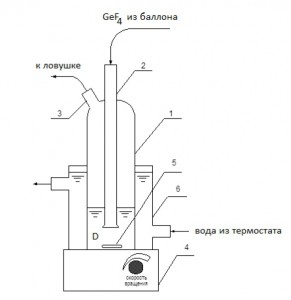
Рисунок 1. Схема установки для получения комплексных соединений GeF4·D: 1– ячейка с комплексообразователем; 2 – капилляр ввода газа; 3– выходной патрубок; 4 – магнитная мешалка; 5– перемешивающее устройство; 6 – термостатируемый цилиндр.
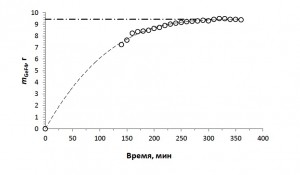
Рисунок 2. Пример изменения количества тетрафторида германия (m(GeF4 ), поглощенного комплексообразователем (МФЭ) во времени при Т = (295 ± 1) К.
В качестве комплексообразователей использовали органические вещества разных классов: пентанол нормального строения, трибутилфосфат (ТБФ) и метил-фениловый эфир (МФЭ или анизол). Предварительно указанные растворители очищали вакуумной ректификацией на колонне с числом теоретических ступеней разделения 20 – 24, контролируя качество очистки по показателю преломления на цифровом рефрактометре J357 Rudolph Research Analytical. Особому контролю подлежало микросодержание воды в очищенных комплексообразователях. Концентрацию H2O определяли титрованием с реактивом Фишера. Содержание воды в используемых комплексообразователях составляло (0,002– 0,02) % мас.
Результаты и их обсуждение
Исследование образования комплексных соединений GeF4 с тремя вышеуказанными органическими соединениями выполнено при атмосферном давлении и при комнатной температуре T = (295 ± 1) К (таблица 1).
Таблица 1. Мольное отношение для комплексов GeF4 с органическими соединениями в системе GeF4(газ) – GeF4·D(ж) при температуре (295 ± 1) К
|
Мольное отношение r ± ∆r, моль GeF4/моль D |
Комплексообразователь D |
||
|
С5H11OH (пентанол-1) |
(СH3O)3PO (ТМФ) |
СH3OC6H5 (МФЭ) |
|
|
0,41 ± 0,06 |
0,64 ± 0,06 |
0,56 ± 0,06 |
|
|
Наблюдаемые явления |
Образование белого осадка |
Расслоение жидкости на две фазы |
Появление желтоватого оттенка |
Как следует из полученных данных, значения мольного отношения для разных комплексообразователей довольно близки между собой и находятся в интервале r ≈ (0,35 – 0,7) моль GeF4/моль D по границам доверительного интервала. Наибольшее значение r при этом достигается в системе GeF4(газ) – GeF4·ТМФ(ж), однако, в этом случае происходит потеря гомогенности жидкой фазы, что, вероятно, обусловлено различной природой образующихся комплексных соединений. Еще менее обнадеживающие результаты относятся к системе GeF4(газ) – GeF4·С5H11OH(ж), в которой наблюдается выпадение твердой фазы, вызваное, скорее всего, дегидратацией ROH в кислой среде с последующим гидролизом GeF4 аналогично данным [3].
Наиболее обнадеживающие результаты получены для третьей из исследованных систем GeF4(газ) – GeF4·МФЭ(ж), в которой значение мольного отношения близко к r = 0,5 моль GeF4/моль СH3OC6H5. Это, при прочих равных условиях, примерно в два раза меньше по сравнению с системой BF3(газ) – BF3·СH3OC6H5(ж) [6], но в два раза больше по отношению к комплексам SiF4 с ROH [1, 3].
В целом, полученные при комнатной температуре и атмосферном давлении данные по фазовому равновесию в системе GeF4(газ) – GeF4·D(ж) указывают на целесообразность более детального изучения комплексного соединения тетрафторида германия с фенил-метиловым эфиром.
Работа выполнена в ЦКП «Центр коллективного пользования имени Д.И. Менделеева» в рамках ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2013 годы», ГК № 16.552.11.7046.
Библиографические источники
1. Хорошилов А.В., Чередниченко С.А., Лизунов А.В., Федорова С.Н. Разделение изотопов кремния методом химического обмена между тетрафторидом кремния и его комплексными соединениями с алифатическими спиртами // Химическая технология. — 2009. – Т. 10, № 4. – С. 197 – 202.
2. Хорошилов А.В., Степанов А.В., Лизунов А.В., Зернова Е.В. Первое разделение изотопов бора методом химического обмена при пониженной температуре в системе трифторид бора – его комплексное соединение с нитрометаном // Перспективные материалы. – 2010. Спец. вып. (8). – С. 258-262.
3. Чередниченко С.А., Хорошилов А.В., Фёдорова С.Н., Степанов А.В. Особенности массообмена при разделении изотопов кремния химическим обменом между SiF4 и его комплексами с ROH // Успехи в химии и химической технологии: Сб. науч. тр. – М.: РХТУ им. Д.И. Менделеева, 2006. – Т.20, № 8. – С. 36 – 40.
4. Egiazarov A. Separation of silicon isotopes by chemical isotopic exchange method / A. Egiazarov, T. Abzianidze, A. Razmadze // Synthesis and applications of isotopically labelled compounds. – Ed. by U. Pleiss, R. Voges. – 2001. Vol. 7. – P. 25 – 28.
5. Hada M. High coordinate germanium and tin complexes in the allylation reactions of aldehydes / M. Hada, H. Nakatsuji, J. Ushio, M. Izawa, H. Yokono // Organometallics. 1993. Vol. 12, № 9. – P. 3398 – 3404.
6. Katalnikov S.G. Physico-chemical and engineering principles of boron isotopes separation by using BF3 – anisole×BF3 system // Separation Science and Technology. – 2001. Vol. 36, № 8-9. – P. 1737 – 1768.
7. Khoroshilov A.V., Lizunov A.V., Stepanov A.V., Cherednichenko S.A. Thermal dissociation of the complex BF3·D and boron isotope separation in the system BF3–BF3·CH3NO2 // Radiochemistry. – 2009. – V. 51. – № 4. – p. 400–402.
8. Levason W. Coordination complexes of silicon and germanium halides with neutral ligands / W. Levason, G. Reid, W. Zhang // Coordination Chemistry Reviews. – 2011. Vol. 255. – P. 1319 – 1341.