Введение
Известно, что длина электромагнитных волн бывает самой различной: от значений порядка 103 м (радиоволны) до 10-8 см (рентгеновские лучи). Свет составляет ничтожную часть широкого спектра электромагнитных волн. Тем не менее, именно при изучении этой малой части спектра были открыты другие излучения с необычными свойствами. Ультрафиолетовое излучение (УФИ, УФ-излучение) – невидимое глазом электромагнитное излучение, занимающее область между нижней границей видимого спектра и верхней границей рентгеновского излучения. Длина волны УФ-излучения лежит в пределах от 100 до 400 нм (1 нм = 10-9 м). По классификации Международной комиссии по освещению (CIE) спектр УФ-излучения делится на три диапазона: 1) UV-A – длинноволновое (315 – 400 нм.); 2) UV-B – средневолновое (280 – 315 нм.); 3) UV-C – коротковолновое (100 – 280 нм.) [1]. Высокая химическая активность, невидимо, большая проникающая способность, убивает микроорганизмы, в небольших дозах благотворно влияет на организм человека (загар), но в больших дозах оказывает отрицательное биологическое воздействие: изменения в развитии клеток и обмене веществ, действие на глаза. В современном мире УФИ находит самое широкое применение в различных областях. Применение УФИ в медицине связано с тем, что оно обладает бактерицидным, мутагенным, терапевтическим (лечебным), антимикотическими и профилактическими действиями, дезинфекция; лазерная биомедицина. В косметологии УФ-облучение широко применяется в соляриях для получения ровного красивого загара. Дефицит ультрафиолетовых лучей (УФ-лучей) ведёт к авитаминозу, снижению иммунитета, слабой работе нервной системы, появлению психической неустойчивости. УФИ оказывает существенное воздействие на фосфорно-кальциевый обмен, стимулирует образование витамина D и улучшает все метаболические процессы в организме. Следует подчеркнуть, что использование УФИ как физического фактора воздействия на микроорганизмы может обеспечить обеззараживание среды обитания в очень высокой степени, например до 99, 9 %. Технология формования полимерных изделий под действием УФИ (фотохимическое формование) находит применение во многих областях техники. В частности, эта технология широко применяется в полиграфии и в производстве печатей и штампов. Также УФ-излучение используется в криминалистике. Учёные разработали технологию, позволяющую обнаруживать малейшие дозы взрывчатых веществ. В приборе для обнаружения следов взрывчатых веществ используется тончайшая нить (она в две тысячи раз тоньше человеческого волоса), которая светится под воздействием УФИ, но всякий контакт со взрывчаткой: тринитротолуолом или иными используемыми в бомбах взрывчатыми веществами, прекращает её свечение. Прибор определяет наличие взрывчатых веществ в воздухе, в воде, на ткани и на коже подозреваемых в преступлении. Также УФ-излучение используется в современном шоу-бизнесе в осуществлении освещения и постановке световых эффектов [2]. Ультрафиолет (УФ) излучается всеми твёрдыми телами, у которых t >1000 о С, а также светящимися парами ртути. Основными источниками УФ-излучения являются: звёзды (в т. ч. Солнце); лазерные установки; газоразрядные лампы с трубками из кварца (кварцевые лампы), ртутные; ртутные выпрямители [3].
Известно, что УФ-излучение оказывает на человека 2 типа воздействия: позитивное и негативное. В солнечном свете 40 % спектра составляет видимый свет, 50 % – инфракрасное излучение и 10 % – УФ. Общеизвестно, что именно УФ-лучи инициируют процесс образования витамина D, который необходим для усвоения организмом кальция и обеспечения нормального развития костного скелета. Кроме того, ультрафиолет активно влияет на синтез гормонов, отвечающих за суточный биологический ритм. Исследования показали, что при облучении УФ-лучами сыворотки крови в ней на 7 % увеличивалось содержание серотонина – «гормона бодрости», участвующего в регуляции эмоционального состояния. Также серотонин является нейромедиатором (НМ) возбуждающего действия. Его дефицит может приводить к депрессии, колебаниям настроения. При этом количество мелатонина, обладающего тормозящим действием на эндокринную (ЭC) и центральную нервную (ЦНС) системы, снижалось на 28 % [4]. Ещё один аспект позитивного влияния УФ-лучей на организм – их бактерицидная функция. Негативное влияние УФ-лучей обусловлено тем, что существует ряд эффектов, возникающих при воздействии УФ-излучения на организм человека, которые могут приводить к ряду серьёзных структурных и функциональных повреждений. Как известно, эти повреждения можно разделить на: 1) вызванные большой дозой облучения, полученной за короткое время (например, солнечный ожог). Они происходят преимущественно за счёт лучей UV-B, энергия которых многократно превосходит энергию лучей UV-A и 2) вызванные длительным облучением умеренными дозами. Они возникают преимущественно за счёт лучей спектра UV-A, которые несут меньшую энергию, но способны глубже проникать в кожу, и их интенсивность мало меняется в течение дня и практически не зависит от времени года. Так как коротковолновый ультрафиолет (УФ) из-за эффективного поглощения озоном атмосферы поверхности земли не достигает, то биологически активным является УФ-свет с длиной волны более 290 нм. Уменьшение озонового слоя атмосферы над некоторыми широтами представляет большую опасность для организмов. Наиболее разрушительный эффект, в том числе с летальным исходом, оказывают фотоны UV-B и UV-C излучения, действующие на биологические объекты на всех уровнях их организации от молекулярного до экосистемного [5]. Жёсткое УФИ могло быть именно тем фактором, который заставил первые органические молекулы соединяться вместе для создания рибонуклеиновой кислоты (РНК), которая считается основой жизни. Но, не будь озонного слоя, все живое на земле исчезло бы под действием солнечной радиации, в состав которой входит и УФИ [6].
На сегодняшний день гипотиреоз (ГПТ) является наиболее часто встречаемым и наиболее изученным синдромом в ЭС [7]. Тем не менее, в диагностике и лечении этого состояния остаётся много вопросов, не имеющих однозначной трактовки. Поэтому среди учёных разных стран не ослабевает интерес к изучению различных аспектов ГПТ, клинического синдрома, обусловленного стойким дефицитом тиреоидных гормонов (ТГ) в организме [8]. Актуальность проблемы ГПТ в клинической практике врачей различных специальностей обусловлена тем, что при дефиците ТГ, необходимых для нормального функционирования практически каждой клетки, развиваются тяжёлые нарушения во всех без исключения органах и системах. ГПТ подразделяется на первичный, вторичный и третичный. Наиболее часто встречается первичный ГПТ, развивающийся вследствие разрушения (удаления) щитовидной железы (ЩЖ) [9]. Основными причинами приобретённого первичного ГПТ являются хронический аутоиммунный тиреоидит, оперативные вмешательства на ЩЖ, терапия радиоактивным йодом 131I по поводу различных форм зоба [10].
По степени тяжести ГПТ классифицируется на субклинический, манифестный и осложнённый [12]. Cубклиническим ГПТ (СГПТ) обозначается лёгкая недостаточность ЩЖ, при которой определяется изолированное повышение уровня тиреотропного гормона гипофиза (ТТГ) при нормальном уровне общих и свободных ТГ в крови [13]. Под манифестным ГПТ (МГПТ) подразумевается недостаточность функции ЩЖ, при которой выявляется повышенный уровень ТТГ и снижение уровня общих и свободных ТГ. Об осложнённом ГПТ (ОГПТ) говорят в ситуации, когда ГПТ привёл к тяжёлым соматическим или неврологическим расстройствам, таким как кретинизм, сердечная недостаточность, полисерозит, микседематозная кома и др. В настоящее время такие состояния практически не встречаются, поэтому многие авторы выделяют лишь СГПТ и МГПТ [14].
Известно, что ТГ трийодтиронин (Т3) и тироксин (Т4) играют важную роль в деятельности ряда жизненно важных функций организма, в частности, в регуляции обмена веществ путём стабилизации внутренней среды организма. Многие явления, возникающие как следствие недостатка гормонов ЩЖ, могут быть устранены введением йодидов и ТГ [15].
Исходя из рассмотрения системы нейроэндокринной регуляции клетки, известно, что данную систему помимо ТГ и стероидных гормонов, составляют также НМ, одним из которых является возбуждающий НМ ацетилхолин, являющийся одним из эфиров холина [16].
Известно, что холин (от греч, choly – жёлчь), гидроокись 2-оксиэтилтриметиламмония, [(CH3)3N+CH2CH2OH] OH-. Бесцветные кристаллы, хорошо растворимые в воде, этиловом спирте, нерастворимые в эфире, бензоле. Холин легко образует соли с сильными кислотами, его водные растворы обладают свойствами сильных щелочей. Холин широко распространён в живых организмах. Холин входит в состав фосфолипидов (например, лецитина, сфингомиелина), служит источником метильных групп в синтезе метионина [17]. В коррекции соматических и нейрогенных нарушений важна роль холиновых эфиров N-замещённых-α, β-дегидроаминокислот (ХЭА), заслуживающих существенного внимания с точки зрения особенностей их синтеза и биологической активности [18].
Согласно результатам исследований [19] эфирами и амидами холина натурального и синтетического происхождения осуществляется ряд важнейших функций в организме человека и животных. Вместе с тем продолжают отсутствовать сведения относительно применения сверхмалых доз (СМД) ХЭА, в частности, холинового эфира N-(2-метокибензоил)-О-изопропил-α, β-дегидротирозина (ХЭД1) и холинового эфира N-(2-метокибензоил)-О-метил-α, β – дегидротирозина (ХЭД2), синтезированных в Научно-технологическом центре органической и фармацевтической химии Национальной Академии наук Республики Армении под руководством доктора химических наук, профессора Топузяна В. О., в изучении особенностей изменения концентрации ТТГ и ТГ в сыворотке крови у крыс при патологии ЩЖ млекопитающих типа МГПТ.
В данном научном исследовании, исходя из вышесказанного, исследовано действие СМД ХЭД1 и ХЭД2 (10-13 – 10-17 М), подвергнутых действию УФИ, на изменение концентрации ТТГ, Т3, Т4, в сыворотке крови у крыс посредством метода иммуноферментного анализа (ИФА).
Методы
При изучении кратковременного действия УФИ на ХЭД1 и ХЭД2, использовался прибор RIDDER-2A, производства Китайской Народной Республики, снабжённый ртутно-кварцевой лампой ODRA-1 со сплошным спектром излучения (220 – 700 нм). Расстояние от лампы до объекта составляло 60 см, доза излучения 2, 5 * 106 Дж*м-2, определялась уфиметром LERD-3i (China).
Исследования проведены на 310 двенадцатимесячных крысах-самцах (линии Вистар, массой 200 – 250 г). МГПТ вызывался путём проведения тиреоидэктомии (ТЭК). ТЭК осуществлялась по следующему алгоритму. До проведения операции крысы под эфирным наркозом фиксировались в положении на спине. Доступ к ЩЖ осуществлялся через разрез кожи в области шеи длиной около 3,5 – 4 см. Затем обнажалась ЩЖ, производилась отпрепаровка 2/3 её части с сохранением паращитовидных желёз и с помощью острых ножниц доли отсекались, после чего под каждую из них подводились лигатуры. Раны послойно зашивались. Животные хорошо переносили операцию и спустя 0,5 – 1 час после операции подходили к корму и воде. После ТЭК и окончания 14 дневных внутримышечных инъекций СМД ХЭД1 и ХЭД2 подвергнутых УФИ, у исследуемых животных была проведена декапитация и осуществлён сбор крови.
Животные были разделены на следующие 6 подопытных групп:
- Интактные животные – 60 шт.
- Контрольные животные с МГПТ, вызванным ТЭК – 50 шт.
- Крысы с МГПТ, вызванным ТЭК, получавшие СМД ХЭД1 в диапазоне 10-13 М – 50 шт.
- Крысы с МГПТ, вызванным ТЭК, получавшие СМД ХЭД1 в диапазоне 10-17 М – 50 шт.
- Крысы с МГПТ, вызванным ТЭК, получавшие СМД ХЭД2 в диапазоне 10-13 М – 50 шт.
- Крысы с МГПТ, вызванным ТЭК, получавшие СМД ХЭД1 в диапазоне 10-17 М – 50 шт.
В сыворотке с помощью метода ИФА определялась концентрация ТТГ, общего Т3 и общего Т4 посредством иммуноферментного анализатора RISER 8793 (China), разработанного для качественной или количественной оценки результатов ИФА и используемого в медицине, биологии, фармакологии, пищевой промышленности, сельском хозяйстве и ветеринарии и в службах санэпиднадзора. Сущность ИФА заключается в специфическом взаимодействии антитела и антигена с последующим присоединением к полученному комплексу коньюгата (антивидового иммуноглобулина, меченного ферментом). Фермент вызывает разложение хромогенного субстрата с образованием окрашенного продукта, который выявляется либо визуально, либо фотометрически. Регистрацию результатов реакции проводят на специальных фотометрах с вертикальным лучом при определённой длине волны. Результат выражают в единицах оптической плотности. ИФА по сравнению с другими методами выявления антигенов и антител обладает следующим преимуществом: высокой чувствительностью, позволяющей выявлять концентрации до 0,05 нг/мл [20]. В данных сериях исследований принцип работы набора заключался в том, что определение уровня ТТГ (или ТГ) основано на использовании конкурентного варианта твердофазного ИФА. На внутренней поверхности лунок планшета иммобилизованы машинные моноклональные антитела к ТТГ (или ТГ). В лунке планшета вносят исследуемый образец и конъюгат (Т4, конъюгированный с пероксидазой). Во время инкубации ТТГ (или ТГ) образца конкурирует с конъюгированным ТТГ (или ТГ) за связывание с антителами на поверхности лунки. В результате образуется связанный с пластиком «сэндвич», содержащий пероксидазу. Во время инкубации с раствором субстрата тетраметилбензидина происходит окрашивание растворов в лунках. Интенсивность окраски обратно пропорциональна концентрации ТТГ (или ТГ) в исследуемом образце. Концентрацию ТТГ (или ТГ) в исследуемых образцах определяют по калибровочному графику зависимости оптической плотности от содержания ТТГ (или ТГ) в калибровочных пробах.
Статистическая обработка результатов производилась в среде «Statistica 6.0 for Windows» по методу «ANOVA» с post-hoc анализом по U-критерию Манна-Уитни. Сравнение полученных результатов до и после воздействия производилось по критерию Вилкоксона для непараметрических данных, разброс данных на рисунках – стандартное отклонение.
Результаты
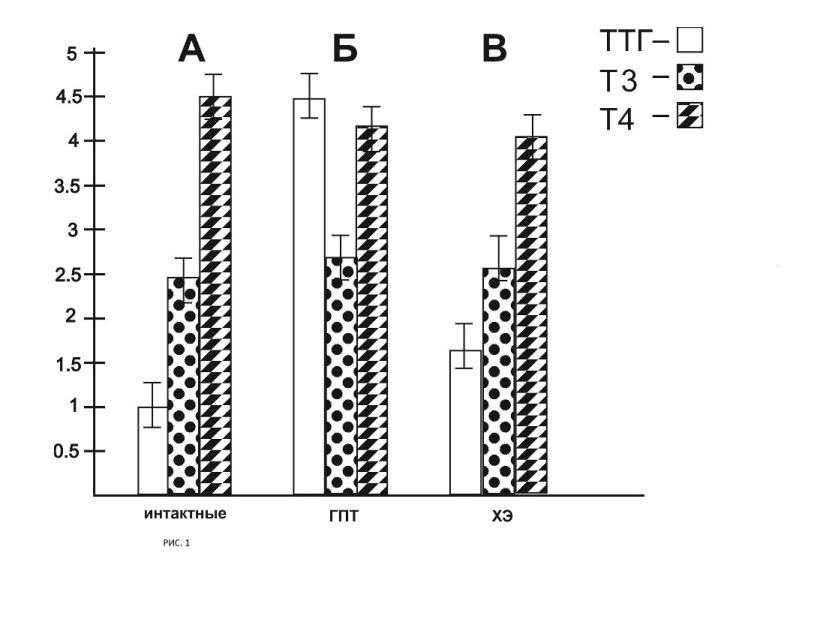
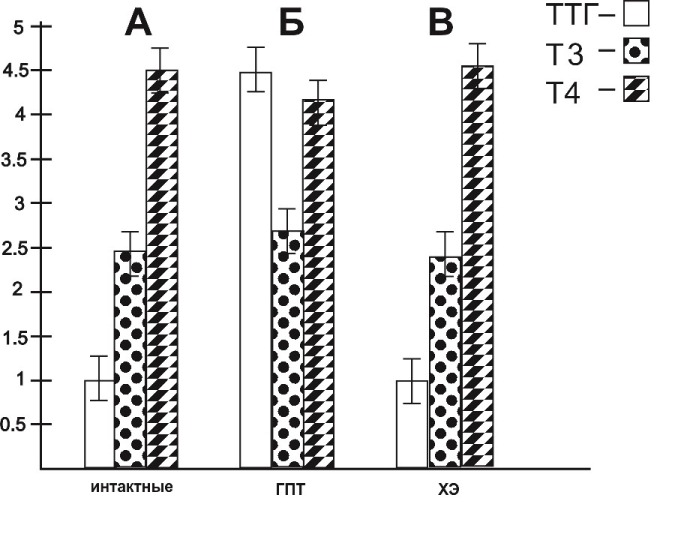
В данных сериях исследований у двенадцатимесячных крыс с МГПТ происходило повышение содержания уровня ТТГ в сыворотке крови на 543, 5 % и снижение уровней общих Т3 на 5, 3 % и Т4 на 6, 1 % (рис. 1, Б) по сравнению с их исходными уровнями (рис. 1, А). После двухнедельного воздействия СМД ХЭД1 10-13 М подвергнутому УФИ у гипотиреоидных крыс в сыворотке крови отмечалось: понижение содержания ТТГ до 106, 3 %; повышение содержания общего Т3 на 3, 7 %; повышение содержания общего Т4 на 5, 4 % (рис. 1, В), по сравнению с животными с МГПТ, не получавших данной СМД ХЭД1 (рис. 1, Б).
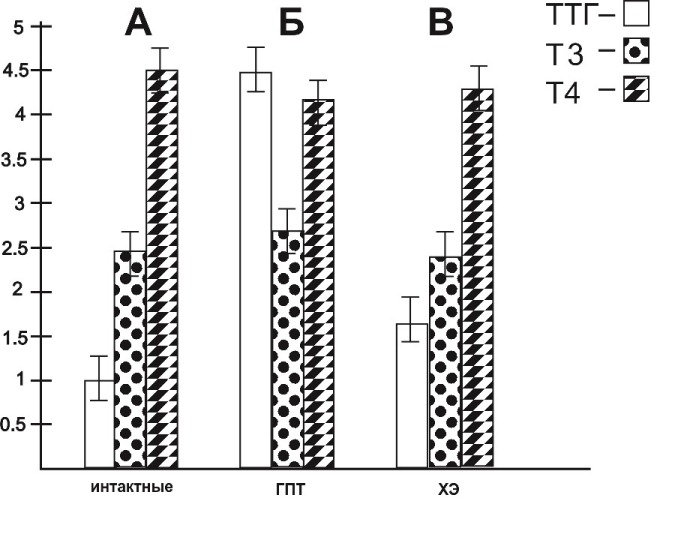
В следующих сериях исследований у двенадцатимесячных крыс с МГПТ происходило повышение содержания уровня ТТГ в сыворотке крови на 591, 2 % и снижение уровней общих Т3 на 5, 1 % и Т4 на 6, 8 % (рис. 2, Б) по сравнению с их исходными уровнями (рис. 2, А). После двухнедельного воздействия СМД ХЭД1 10-17 М подвергнутому УФИ у гипотиреоидных крыс в сыворотке крови отмечалось: понижение содержания ТТГ до 100, 7 %; повышение содержания общего Т3 на 3, 1 %; повышение содержания общего Т4 на 5, 2 % (рис. 2, В), по сравнению с животными с МГПТ, не получавших данной СМД ХЭД1 (рис. 2, Б).
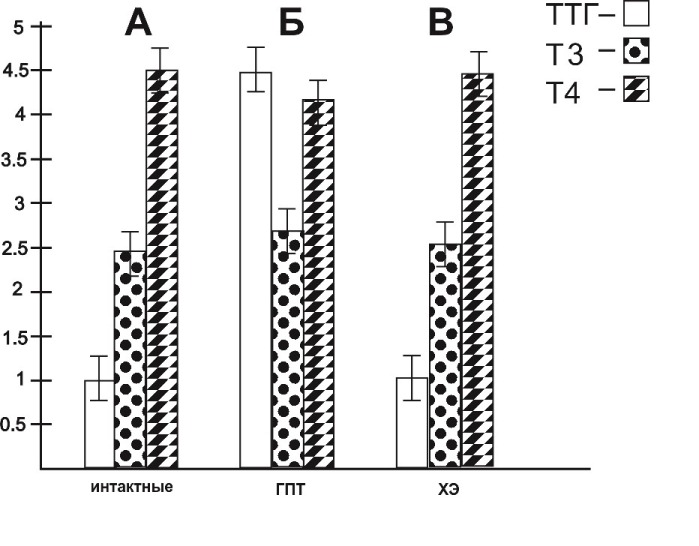
В следующих сериях исследований у двенадцатимесячных крыс с МГПТ происходило повышение содержания уровня ТТГ в сыворотке крови на 603 % и снижение уровней общих Т3 на 4, 8 % и Т4 на 6, 2 % (рис. 3, Б) по сравнению с их исходными уровнями (рис. 3, А). После двухнедельного воздействия СМД ХЭД2 10-13 М подвергнутому УФИ у гипотиреоидных крыс в сыворотке крови отмечалось: понижение содержания ТТГ до 117, 8 %; повышение содержания общего Т3 на 3, 9 %; повышение содержания общего Т4 на 4, 3 % (рис. 3, В), по сравнению с животными с МГПТ, не получавших данной СМД ХЭД2 (рис. 3, Б).
В следующих сериях исследований у двенадцатимесячных крыс с МГПТ происходило повышение содержания уровня ТТГ в сыворотке крови на 597, 5 % и снижение уровней общих Т3 на 5, 5 % и Т4 на 6, 2 % (рис. 4, Б) по сравнению с их исходными уровнями (рис. 4, А). После двухнедельного воздействия СМД ХЭД2 10-17 М подвергнутому УФИ у гипотиреоидных крыс в сыворотке крови отмечалось: понижение содержания ТТГ до 102, 2 %; повышение содержания общего Т3 на 3, 4 %; повышение содержания общего Т4 на 4, 6 % (рис. 4, В), по сравнению с животными с МГПТ, не получавших данной СМД ХЭД2 (рис. 4, Б).
Обсуждение
В лечении и реабилитации больных с различными болезнями большое место занимают лечебные физические факторы, как природные, так и получаемые искусственно. Лечебные физические факторы оказывают гомеостатическое влияние на различные органы и системы, способствуют повышению сопротивляемости организма к неблагоприятным воздействиям, усиливают его защитно-приспособительные механизмы, обладают выраженным лечебным действием, повышают эффективность других терапевтических средств и ослабляют побочные эффекты лекарств. Их применение доступно, высокоэффективно и экономически выгодно [21].
Очень важно понять, что УФ-физиотерапия является одним из важнейших компонентов всего комплекса физических методов лечения и реабилитации больных. Достоинство лечебных физических факторов в полной мере реализуется при их правильном применении и комбинировании с другими лечебно-профилактическими и реабилитационными мероприятиями [22].
Как было отмечено выше, механизм действия УФ-лучей основан на способности некоторых атомов и молекул избирательно поглощать энергию света. В результате этого молекулы тканей переходят в возбуждённое состояние, что запускает фотохимические процессы в чувствительных к УФ-лучам молекулах белка, дезоксирибонуклеиновой кислоты (ДНК) и РНК. Фотолиз белков эпидермальных клеток приводит к высвобождению биологически активных веществ (гистамина, ацетилхолина, простагландинов и др.), которые при поступлении в кровоток вызывают расширение сосудов, миграцию лейкоцитов [23]. Не меньшее значение имеют рефлекторные реакции, вызванные активацией многочисленных рецепторов продуктами фотолиза и биологически активными веществами, а также гуморальное воздействие на ЦНС, ЭC, иммунную и другие системы организма. Естественно, что УФ-излучение вызывает ответные реакции со стороны организма человека, которые и составляют основу физиологического и лечебного действия УФ-лучей. Одним из основных компонентов этого лечебного действия являются эффекты, связанные с формированием ультрафиолетовой (или фотохимической) эритемы. Максимальным эритемообразующим свойством обладает СУФ-излучение с длиной волны 297 нм. Широко используется бактерицидное действие УФ-облучения. Различают прямое и непрямое бактерицидное действие УФ-лучей. В результате прямого действия происходит коагуляция и денатурация белков микроорганизмов на поверхности раны, слизистой оболочке, что приводит к гибели бактериальной клетки. Непрямое действие УФ-излучения связано с изменением иммунобиологической реактивности организма под влиянием УФ-лучей [24].
УФ-лучи активно влияют на липидный, белковый и углеводный обмен. Под влиянием их субэритемных доз в коже из производных холестерина синтезируется витамин D3, контролирующий фосфорно-кальциевый обмен. Они снижают содержание атерогенного холестерина крови у больных атеросклерозом [25]. УФ-лучи в малых дозах улучшают процессы высшей нервной деятельности, улучшают мозговое кровообращение, влияют на тонус мозговых сосудов, повышают устойчивость организма к неблагоприятным факторам окружающей среды. Тонус вегетативной нервной системы изменяется в зависимости от дозы УФ-излучения: большие дозы уменьшают тонус симпатической системы, а малые – активируют симпатоадреналовую систему, корковый слой надпочечников, функцию гипофиза, ЩЖ. Благодаря своему многообразному действию, УФ-облучение (наряду с УВЧ-терапией и ультразвуковой терапией) нашло широкое применение для профилактики и лечения широкого спектра заболеваний [26].
Анализируя влияние подвергнутых УФ-облучению СМД ХЭД1 и ХЭД2 10-13 и 10-17 М на изменение концентрации ТТГ у крыс с МГПТ в данной возрастной группе животных, можно отметить, что наибольший протекторный эффект от воздействия данных химических соединений наблюдается при использовании их СМД 10-17 М с восстановлением показателей ТТГ и ТГ практически до нормы. Таким образом, полученные данные свидетельствуют об оптимальной эффективности применения СМД 10-17 М подвергнутой УФИ в восстановлении показателей концентрации ТТГ и ТГ в сыворотке крови у двенадцатимесячных гипотиреоидных крыс.
В настоящее время все более широкое распространение приобретают заболевания, связанные с угнетением функции ЩЖ. Всестороннее изучение патогенеза этих заболеваний позволило разработать эффективные методы коррекции сопровождающих их метаболических расстройств, что внесло существенный вклад в разработку новых подходов к лечению [27]. Вместе с тем все еще существует целый ряд нерешённых проблем, связанных с ограниченными представлениями о молекулярных механизмах развития МГПТ [28]. Особый интерес в связи с этим представляет выяснение возрастных особенностей изменения регуляции функции ЩЖ при МГПТ. Всестороннее изучение этого вопроса открывает перспективы в разработке новых подходов к лечению осложнений МГПТ у разных возрастных групп животных [29].
Таким образом, при исследовании аспектов МГПТ: основная задача лечения – восстановление нормальных физиологических функций всех органов и систем, нарушенных вследствие МГПТ. Критерием адекватности лечения служит исчезновение клинических и лабораторных проявлений МГПТ [30].
Библиографический список
- Barbhaiya M, Costenbader Kh. Ultraviolet radiation and systemic lupus erythematosus. Lupus. 2014, 23, (6):588-95.
- Singh J, Singh RP. Adverse Effects of UV-B Radiation on Plants Growing at Schirmacher Oasis, East Antarctica. Toxicol Int. 2014 Jan;21 (1):101-6.
- Risović D, Maver-Bišćanin M, Mravak-Stipetić M, Bukovski S, Bišćanin A. Quantitative Investigation of Efficiency of Ultraviolet and Visible Light in Eradication of Candida albicans In Vitro. Photomed Laser Surg. 2014 Apr; 32 (4):232-9.
- Piérard GE, Piérard-Franchimont C, Delvenne P. Environmental effects on the stratum corneum. Rev Med Liege. 2014 Feb; 69 (2):68-71.
- Веселовкий ВА., Весёлова ТЕ. Люминисценция растений. М., Наука, 1990: 200 с.
- Минасян АДж., Джавршян ДжМ. Влияние УФ-излучения на «Гиперхромный эффект» в листьях растений, вызванный газообразным аммиаком. Учёные записки ЕГУ, 2009, (3): 27 – 35.
- Шацева Е. И., Кононов Е. И., Суслонова Г. А., Романова Т. Б. Особенности липидного обмена у больных с тиреоидной патологией, жителей европейского севере СССР. Терапевтический архив. 1991, 63, (10): 10 – 16.
- Кадырова ДА., Атаханова БА., Туракулов ЯХ. Изучение полиморфизма гена тиреоглобулина щитовидной железы человека. Проблемы эндокринологии, 1996, 42, (5): 34 – 37.
- Кандрор ВИ., Крюкова ИО., Крайнова СИ. Антитиреоидные антитела и аутоимунные заболевания. Проблемы эндокринологии, 1997, 43, (3): 28 – 30.
- Селятицкая ВГ., Одинцов СВ., Обухова ЛА. Морфофункциональные изменения щитовид-ной железы у лабораторных животных при действии холода. Проблемы эндокринологии, 1998, 44, (4): 40 – 42.
- Кубасов РВ. Современные представления о роли факторов внешней среды и дисбаланса биоэлементов в формировании эндемического зоба. Успехи современной биологии, 2009, 129, (2): 181 – 190.
- Фадеев ВВ., Мельниченко ГА. Гипотиреоз (руководство для врачей). М., “РКИ Северо пресс”, 2002, 232 c.
- Терещенко ИВ. Патогенез, диагностика и лечение субклинического гипотиреоза. Клиническая медицина, 2000, 78, (9): 8 – 13.
- Фадеев ВВ. Современные концепции диагностики и лечения гипотиреоза у взрослых. Проблемы эндокринологии, 2004, 2: 1–7.
- Aksoy DY., Cinar N, Harmanci A, Karakaya J, Yildiz BO, Usman A, Bayraktar M. Serum resistin and high sensitive CRP levels in patients with subclinical hypothyroidism before and after L-thyroxine therapy. Med. Sci. Monit., 2013, 22, (19): 210 – 215.
- Amino N, Ide A, Tamai H. Concept and management of postpartum thyroid dysfunction. Nihon Rinsho, 2012, 70, (11): 1983 – 1987.
- Zeisel SH. Nutritional Importance of Choline for Brain Development. Am. J. Clin. Nutr., 2004, 9: 621 – 626.
- Киприян ТК, Топузян ВО, Карапетян ИР, Хачатрян ТС. Анализ влияния сочетанного комплекса тироксина и йодметилата 2 – (диметиламно) этилового эфира – N – (п – метоксибензоил) – DL – фенилаланина на электрическую активность повреждённых травмой одиночных мотонейронов спинного мозга крыс. В сб. Международная научная конференция «Актуальные проблемы интегративной деятельности и пластичности нервной системы» посвящ. 80 – летию со дня рождения академика НАН РА и чл. – корр. РАН В. В. Фанарджяна, 2009, Ереван, Изд. «Гитутюн» НАН РА: 154 – 158.
- Хачатрян ТС, Арутюнян ЭЮ, Топузян ВО, Карапетян ИР, Авакян АЭ. Сравнительный анализ действия некоторых производных холина на внеклеточную электрическую активность одиночных мотонейронов спинного мозга крыс в условиях экспериментального гипотиреоза. Ж. Биолог. Журн. Армении, 2010, 4, (LXII): 12 – 19.
- Kasdallah AG, Mornagui B, Gharbi N, Machghoul S, El-Fazâa S. Metabolic and endocrine effects of water and/or food deprivation in rats. C R Biol. 2005, 328, (5): 463 – 470.
- Coleman DJ, Garcia G, Hyter S, Jang HS, Chagani S, Liang X, Larue L, Ganguli-Indra G, Indra AK. Retinoid-X-Receptors (α/β) in Melanocytes Modulate Innate Immune Responses and Differentially Regulate Cell Survival following UV Irradiation. PLoS Genet. 2014 May 8; 10, (5): e1004321.
- Volkov VV, Kharitonova NN, Mal’tsev DS. Tanning lamp radiation-induced photochemical retinal damage. Vestn Oftalmol. 2014, Jan-Feb; 130, (1):63-72.
- Nanbu T, Shimada J, Kobayashi M, Hirano K, Koh T, Machino M, Ohno H, Yamamoto M, Sakagami H. Anti-UV activity of lignin-carbohydrate complex and related compounds. In Vivo. 2013, Jan-Feb; 27, (1):133-9.
- Hirose E, Hirabayashi S, Hori K, Kasai F, Watanabe MM. UV protection in the photosymbiotic ascidian Didemnum molle inhabiting different depths. Zoolog Sci. 2006 Jan; 23, (1): 57 – 63.
- Chacón-Salinas R, Chen L, Chávez-Blanco AD, Limón-Flores AY, Ma Y, Ullrich SE. An essential role for platelet-activating factor in activating mast cell migration following ultraviolet irradiation. J Leukoc Biol. 2014 Jan; 95, (1):139-48.
- Montanha EA, Pavinatto FJ, Caseli L, Kaczmarek O, Liebscher J, Huster D, Oliveira ON Jr. Properties of lipophilic nucleoside monolayers at the air-water interface. Colloids Surf B Biointerfaces. 2010 Jun 1;77, (2):161-5.
- Klein I. Subclinical Hypothyroidism–Just a High Serum Thyrotropin (TSH) Concentration or Something Else? Clin. Endocrinol.Metab. 2013, 98, (2): 508 – 510.
- Klein I. Neurologic manifestations of hypothyroidism in dogs. Compend. Contin. Educ. Vet., 2013, 35, (3): 1 – 7.
- Köhrle J, Brabant G. Synthesis, metabolism and diagnostics of thyroid hormones. Internist (Berl), 2010, 51, (5): 559 – 567.
- Parrat D., Meyer P. Endocrinology in 2012: what’s new? Rev. Med. Suisse, 2013, 9, (368): 36 – 39.