Protection by low doses of thyroxine the changing of electrical activity of single phyramidal neurons of rat’s cortex under experimental hypothyreosis
T. S. Khachatryan
Institute of applied problems of physics of NAS RA, Yerevan
In these series of investigations the question of the use of low doses of thyroxine on rats in norm and experimental hypothyreosis is discussed. The obtained results show the protective effect of thyroxine on extracellular background and evoked electrical activity of single pyramidal neurons of rats with hypothyreosis. The registration and analysis of the electric activity of single pyramidal neurons of rat’s cortex is done by means of the special computer prog¬rams in on-line mode.
Известно, что болезни щитовидной железы (ЩЖ) являются одной из самых распространённых форм патологии человека. В последние годы во многих регионах Армении отмечен значительный рост частоты тиреоидных заболеваний, что связано с ухудшением экологической обстановки, недостаточным поступлением йода, негативными сдвигами в питании населения, возрастанием частоты аутоиммунных заболеваний.
В структуре патологий ЩЖ по частоте и социальной значимости одно из ведущих мест занимает гипотиреоз (ГПТ). ГПТ – клинический синдром, вызванный длительным, стойким недостатком гормонов ЩЖ в организме, сопровождающейся снижением их биологического эффекта на тканевом уровне. Общеизвестно, что ГПТ может быть как врождённым, так и приобретённым в результате поражения ЩЖ различными патологическими процессами. Причины, вызывающие ГПТ бывают весьма разнообразны. Это заболевание может возникнуть в результате длительно протекающих тиреоидитов или струмитов, наличия опухолевого процесса в ЩЖ, а также в послеоперационном периоде на почве тотально произведённой тиреоидэктомии. Причинами развития ГПТ могут быть передозировка радиоактивного йода или избыточная лучевая терапия, а также нарушение регуляторных влияний на ЩЖ со стороны гипоталамо-гипофизарной области головного мозга. В ЩЖ при различных формах ГПТ, кроме выраженных склеротических и атрофических изменений, может нередко сохраняться фолликулярное строение тиреоидной паренхимы с очень низким уплощённым эпителием; в этих случаях конфигурация фолликулов преимущественно неправильная, размеры их значительно уменьшены. Интерфолликулярные островки встречаются редко и образованы они преимущественно мелкими атрофичными клетками тиреоидного эпителия. При стойких, запущенных формах ГПТ в ЩЖ нередко можно обнаружить гнойные воспалительные очаги (струмиты), инфекционные специфические гранулемы сифилитической, туберкулёзной или актиномикотической природы, различного характера новообразования и хронические неспецифические тиреоидиты, приводящие к разрушению тиреоидной паренхимы и значительному снижению, а иногда и полному прекращению её функциональной деятельности (атиреозу) [1, 2].
По данным большинства исследователей [3 – 5], распространенность заболевания среди населения составляет 0,5-1%, а с учетом субклинических форм может достигать 10%. Патогенетически ГПТ подразделяется на: первичный (тиреогенный); вторичный (гипофизарный); третичный (гипоталамический); тканевой (транспортный, периферический). Вторичные и третичные формы ГПТ (так называемый центральный ГПТ) связаны с поражением гипоталамо-гипофизарной системы при таких заболеваниях, как аденомы гипофиза, инфаркты и некрозы гипофиза (развитие их возможно при ДВС-синдроме и массивных кровотечениях) и др. Этиологическими факторами также могут быть воспалительные заболевания головного мозга (менингиты, энцефалиты и др.), хирургические и лучевые воздействия на гипофиз. Снижение функциональной активности ЩЖ при центральных формах ГПТ связано с дефицитом тиреотропного гормона (ТТГ). Дефицит ТТГ при этом может быть изолированным, однако чаще он сочетается с нарушением секреции других тропных гормонов гипофиза (в таких случаях говорят о гипопитуитаризме). Помимо приобретённых форм ГПТ, существуют врождённые формы заболевания. Частота врождённого ГПТ в Армении составляет в среднем 1 случай на 4000 новорожденных. Причинами врожденного ГПТ могут быть: аплазия и дисплазия ЩЖ, генетически обусловленные дефекты биосинтеза тиреоидных гормонов, тяжёлая йодная недостаточность, аутоиммунные заболевания ЩЖ у матери (из-за проникновения тиреоблокирующих антител через плаценту), лечение тиреотоксикоза у матери тиреостатическими препаратами или радиоактивным йодом. К числу редких причин следует отнести врождённый дефицит ТТГ, а также синдром периферической резистентности к тиреоидным гормонам [6].
Общеизвестна роль тиреоидных гормонов в обеспечении нормального развития нервной системы живого организма. В литературе имеются данные относительно применения экзогенных тиреоидных гормонов, приводящих к улучшению функционального восстановления после травмы периферической и центральной нервной системы [7]. Известно, что основное назначение гормонов внутренней секреции – участие в регуляции обмена веществ. Изменяя обмен веществ гормоны стабилизируют внутреннюю среду живого организма, держа под контролем постоянство кальция и фосфора в организме. В данном аспекте немаловажная роль принадлежит гормонам ЩЖ. Ряд работ указывает на влияние гормонов ЩЖ непосредственно на деятельность нервной клетки, на её транспортные системы [8 – 11], другие – на молекулярные механизмы клеточной деятельности [12 – 15]. Важную роль тиреоидные гормоны играют в центральной нервной системе, в частности, в период развития нервной системы [16, 17]. Cерия физиологических работ посвящена изучению стимулирующего влияния тироксина (Т4) на сегментарные рефлекторные реакции спинного мозга при перерезке седалищного нерва [18 – 20]. В наших предыдущих исследованиях были изучены эффекты гормонов коры надпочечников и ЩЖ на активность нейронов спинного мозга в условиях нормального гормонального статуса и при патологии [21 – 25]. В области изучения патологий ЩЖ, таких, как гипертиреоз и ГПТ, был проведён ряд исследований [26 – 29], детально описывающие данные патологии и различные способы воздействий, направленные на их лечение.
Целью настоящего исследования явилось изучение влияния одного из гормонов ЩЖ –Т4 на активность нейрональных элементов коры больших полушарий (КБП) головного мозга (ГМ) у крыс с нормальным гормональным статусом, при ГПТ электрофизиологическими методами.
Материал и методы
Эксперименты были поставлены на 50 крысах – самцах, массой 200 – 220 г, разделённых на следующие подопытные группы: первая – интактные животные – 10 экземпляров; вторая – животные с экспериментальным ГПТ, вызванным тиреоидэктомией – 10 экземпляров третья– животные с экспериментальным ГПТ, получавшие внутримышечные инъекции Т4 в дозе 50 мкг/кг массы тела, в течение 2 недель – 30 экземпляров. Тиреоидэктомия у 40 крыс осуществлялась по следующему алгоритму. Для проведения операции крысы под эфирным наркозом фиксировались в положении на спине. Доступ к ЩЖ осуществлялся через разрез кожи в области шеи длиной около 3,5 – 4 см. Затем обнажалась ЩЖ, производили отпрепаровку 2/3 её части с сохранением паращитовидных желёз и с помощью острых ножниц доли отсекались, после чего под каждую из них подводились лигатуры. Раны послойно зашивались. Животные хорошо переносили операцию и спустя 0,5 – 1 час после операции подходили к корму и воде. За каждым животным в период дачи препаратов велось индивидуальное наблюдение с каждодневной регистрацией клинических показателей. Последующие электрофизиологические исследования биоэлектрических показателей КБП ГМ проводились в остром эксперименте. Электрофизиологическими методами изучалась внеклеточная фоновая (ФА) и вызванная (ВА) электрическая активность одиночных пирамидных нейронов (ПН) КБП ГМ у интактных и гипотиреоидных животных в I – IV cлоях КБП. Регистрацию и анализ внеклеточной ФА и ВА одиночных ПН КБП ГМ производили с помощью специальных программ на компьютере. При записи ВА одиночных ПН КБП ГМ проводилась оценка стационарности престимульной и постстимульной активности нейрона после электрического раздражения седалищного нерва. Выборка спайков проводилась с помощью амплитудного дискриминатора посредством программного анализа. Вычислялась скользящая частота (для каждых 10 межимпульсных интервалов с шагом 5 интервалов), сериальные гистограммы до 50 порядка, гистограммы межимпульсных интервалов на основе которых вычислялась средняя частота фонового нейронального потока одиночных клеток, а также спайковая выборка нескольких (до 20) повторений до и после раздражения. Последующий анализ ФА и ВА одиночных ПН КБП ГМ крыс осуществляли по алгоритму, подробно описанному в наших предыдущих статьях [30, 31].
Результаты и обсуждение
На рисунке 1 приведены примеры кумулятивных и суммированных (пункт 1, гистограммы а, b, c) престимульных и постстимульных гистограмм внеклеточной ФА и ВА одиночного ПН КБП ГМ у интактных животных; у гипотиреоидных животных (пункт 2, а, б, в); у гипотиреоидных животных, получавших Т4 в I слое КБП (пункт 3, а, б, в); у гипотиреоидных животных, получавших Т4 во II слое КБП (пункт 4, а, б, в); у гипотиреоидных животных, получавших Т4 в III слое КБП (пункт 5, а, б, в); у гипотиреоидных животных, получавших Т4 в IV слое КБП (пункт 6, а, б, в). Согласно данным пункта 2, (а, кривые 1 (ФА), 2 (ВА)) в картине внеклеточной ФА и ВА одиночного ПН КБП ГМ наблюдается трансформация регулярного типа разряда ФА одиночного ПН в пачечную «патологическую» активность (пункт 2, а, кривая 1) с почти полным исчезновением вызванного синаптического ответа (пункт 2, а, кривая 2), вызванное, вероятно, патологическим влиянием ГПТ. Анализируя вышеизложенное, можно сделать вывод о том, что при ГПТ происходит резкое урежение ФА и ВА одиночного ПН КБП ГМ крыс, по сравнению с аналогичной картиной данных электрофизиологических показателей у интактных животных (пункт 1, а, кривые 1, 2), что можно объяснить, по – видимому, недостатком кальция, весьма характерным для данной патологии ЩЖ млекопитающих.
После введения Т4 наблюдается эффект нормализации пачечной активности одиночного ПН КБП ГМ с переходом в «нормальный» регулярный разряд ПН с сохранением и увеличением вызванного синаптического ответа в I слое КБП (пункт 3, а, кривые 1, 2), что говорит об усилении действия Т4. Что же касается импульсного потока (пункт 3, b), то здесь, после введения T4, он представлен регулярным видом фонового нейронального разряда ПН. Аналогичные показатели ФА и ВА одиночных ПН КБП ГМ у гипотиреоидных крыс при действии Т4 зарегистрированы нами и в следующих слоях КБП – II cлое (пункт 4, а, б, кривые 1, 2); III слое – (пункт 5, а, б, кривые 1, 2); IV слое – (пункт 6, а, б, кривые 1, 2). Анализируя полученные в наших исследованиях данные, можно сделать вывод, что при введении малых доз Т4 в исследованных четырёх слоях КБП виден эффект нормализации патологического типа разряда одиночных ПН, более выраженный в III, IV слоях КБП ГМ.
Аналогичные сдвиги вызванного ответа при ГПТ в 2 – 3 раза отражены и на суммарных гистограммах (пункт II, в), а при действии Т4 – на суммарных гистограммах ярко проиллюстрирован эффект нормализации ВА одиночного ПН (пункты 3 – 6, в).
Анализируя данный рисунок можно сделать вывод об активирующем протекторном действии малых доз Т4 на внеклеточную ФА и ВА одиночных ПН КБП ГМ крыс при экспериментальной дисфункции ЩЖ – ГПТ.
Также в наших исследованиях были изучены более высокие дозы Т4 (300, 500, 700 мкг/кг массы тела), как в отдельности, так и в разных их сочетаниях; однако выяснилось, что данные дозы оказывают патологическое влияние и на клиническое состояние у подопытных животных (происходит изменение шерстяного покрова, пигментации кожи, потеря ориентации и зрения, вызванные, вероятно, высокой степенью токсичности использованных доз и электрофизиологических показателей ФА и ВА одиночных ПН КБП ГМ, заключающихся в проявлении «пачек», что говорит об оптимальной дозе Т4 при ГПТ у крыс, составляющей от 50 – до 200 мкг/кг массы тела. Изучение эффектов более низких доз Т4 станет предметом наших последующих исследований.
В результате проведенного анализа полученных данных мы пришли к выводу, что в целом имеется положительный эффект от применения Т4 при ГПТ.
Итак, результаты ранее проведенных исследований по изучению действия Т4 [31, 32], а также результаты данной серии исследований показали эффективность действия Т4 на внеклеточную ФА и ВА одиночных ПН КБП ГМ крыс при экспериментально вызванном ГПТ.
Литература
1. Бреславский А. С., Гордиенко В. М. Патологическая анатомия желёз внутренней секреции. Изд. «Здоров’я», Киев, 1974, с. 34 – 35.
2. Jonderko G., Straszecka J., Marcisz C., Wieczorek U. Influence of treating hypothyroidism and hyperthyroidism upon physical reaction time. J. Pol. Arch. Med., 1992, v. 5, № 88, pp. 295 – 301.
3. Jorde R. “Subclinical” thyroid disease. J. Tidsskr. Nor. Lageforen., 2002, № 122, v. 9, pp. 938 – 940.
4. Larsen P. R. Ontogenesis of thyroid function, thyroid hormone and brain development, diagnosis and treatment of congenital hypothyroidism. In: DeGroot L. J., Larsen P. R., Henneman G., eds. The thyroid and its diseases 6th ed. New – York: Churchill Livingstone, 1996, pp. 541 – 567.
5. Ciesielska-Kopacz N., Kos-Kudla B., Pluskiewicz W. The influence of thyroid disesses and their treatment on the development of osteoporosis. J. przegl. Lek., 1998, v. 5, № 55, pp. 271 – 273.
6. Nerush P. O., Demchenko O. M. Effect of hypothyroidism on glial fibrillary acid protein in the structures of the rat brain. J. Fiziol. Zh., 2006, v. 6, № 52, pp. 45 – 51.
7. Cook R. A., Kiernan J. A. Effects of triiodthyronine on protein synthesis in regenerating peripheral neurons. 1976, J. Exp. Neurol., № 52, pp. 515 – 524.
8. Bumgarner J. R., Ramkumar V., Stiles G. L. Altered thyroid status regulates the adipocyte A1 adenosine receptor – adenylatecyclase system. J. Life Sci., 1989, № 44, v. 22, pp. 1705 – 1712.
9. Martin T. F. G., Kovalchyk J. A. Evidence for the role of calcium and diacylglycerol as dual second messengers in thyrotropin – releasing hormone action. Involvement of Ca2+. J. Endocrinology, 1984, № 115, v. 4, pp. 1527 – 1536.
10. Segal J., Ingbar S. H. 3, 5, 3’ – triiodothyronine increases cellular adenosine 3, 5’ – monophosphate concentration and sugar uptake in rat tymocytes by stimulating adenilate cyclase activity: studies with the adenilate cyclase inhibitor MDL 12330 A. J. Endocrinology, 1989, № 124, v. 5, pp. 2166 – 2171.
11. Nistri A. Electrophysiological studies of the mechanism of action of TRH on rat spinal motoneurons. J. Pharmacol. Res., 1990, № 22, v. 2, pp. 363 – 368.
12. Tata J. R. Biological actions of thyroid hormones at the cellular and molecular levels. In «Actions of hormones on molecular processes», 1964, Wiley, New York, London and Sydney, pp. 58 – 131.
13. Menezes – Ferreira M. M., Torresani J. Me’canismus d’action des hormones thyroidennes au niveau cellularie. J. Ann. Endocrinol. (Fr.), 1983, № 44, v. 4, pp. 205 – 216.
14. Таракулов Я. Х., Саатов Т. С., Гулямова Ф. Я., Яковлева Н. Н. Мембранная рецепция тиреоидных гормонов. Ж. Биохимия, 1991, № 56, т. 5, с. 839 – 845.
15. Visser V. E., Friesema E. C., Visser T. J. Transport of thyroxine and 3,3′,5-triiodothyronine in human umbilical vein endothelial cells. J. Endocrinology, 2009, № 150, v. 3, pp. 1552 – 1557.
16. Walker P., Weichel M. E., Fisher D. A., Guo Sh. M. Thyroxine increases nerve growth factor concentration in adult mouse brain. J. Science, 1979, № 204, v. 4391, pp. 427 – 429.
17. Suzuki T., Abe T. Thyroid hormone transporters in the brain. J. Cerebellum., 2008, № 7, v. 1, pp. 75 – 83.
18. Мантуло П. М., Макий Е. А., Сердюченко И. Я. Сегментарные рефлекторные реакции спинного мозга крыс после перерезки седалищного нерва и введения тироксина. Ж. Физиологич. Журн., 1979, № 25, v. 5, pp,. 492 – 496.
19. Макий Е. А., Сердюченко И. Я. Вызванная активность нейронов спинного мозга в ранние сроки после перерезки седалищного нерва. Ж. Нейрофизиология, 1992, № 24, т. 3, с. 306 – 314.
20. Сердюченко И. Я., Коропова Г. Е., Щербина М. Б. Особенности сегментар¬ных реф¬¬лексов после повреждения седалищного нерва у тироксини¬зи¬ро¬ван¬ных крыс. Ж. Нейрофизио¬ло¬-гия, 1992, № 24, т. 6, с. 653 – 659.
21. Киприян Т. К. Изменения электрической активности нейронов спинного мозга кошки под действием гидрокортизона. Ж. Нейрофизиология, 1974, № 6, т. 3, с. 260 – 265.
22. Киприян Т. К. Изменения электрической активности нейронов спинного мозга кошки под действием дезоксикортикостерона. В сб. Материалы 3 съезда Армянского физиологического общества, Ереван, 1979, Изд. АН АрмССР, с. 128 – 137.
23. Киприян Т. К. Нейротропные эффекты кортикостероидных гормонов. Ж. Биол. Ж. Армении, 1987, № 40, т. 2, с. 123 – 128.
24. Матинян Л. А., Аветисян А. А. Влияние симпатической нервной системы на электрокардиограмму и дыхание при тиреотоксикозе у крыс. В сб.: «II съезд Армянского физиологического общества», 1974, Ереван, Изд. АН АрмССР, с. 46 – 52.
25. Киприян Т. К., Матинян Л. А., Хачатрян Т. С., Чавушян В. А. Электрическая активность нейронов спинного мозга крыс при действии тироксина, гипертиреозе и гипотиреозе. Ж. Вопросы теоретической и клинической медицины, 1999, т. 2, № 7 (14), с. 50 – 54.
26. Fertic A., Kiernan J. A., Seyan A. S. Enhancement of axonal regeneration in the brain of the rat by corticotrophin and triiodothyronine. J. Exp. Neurol., 1971, № 33, pp. 372 – 385.
27. Henly W. N., Chen X., Klettner C., Bellush L., Notestine M. A. Hypothyroidism increases serotonin turnover and symphatetic activity in the adult rat. Can. J. Physiol. and Pharmacol., 1991, № 69, v. 2, pp. 205 – 210.
28. Moller N., Mann K. Hypothyroidism treatment: when and what dosage. J. MMW Fortschr. Med., 2009, № 151, v. 14, pp. 34 – 37.
29. Sloter E., Nemec M., Stump D., Holson J., Kirkpatrick D., Gargas M., Kinzell J. Methyl iodide-induced fetal hypothyroidism implicated in late-stage fetal death in rabbits. J. Inhal. Toxicol., 2009, № 21, v. 6, pp. 462 – 479.
30. Хачатрян Т. С. Действие лидазы и тироксина на фоновую электрическую активность одиночных пирамидных нейронов коры больших полушарий крыс. Ж. Биолог. журн. Армении, 3 – 4 (59), 2007, с. 198 – 202.
31. Хачатрян Т. С., Киприян Т. К. Изменение суммарной и одиночной электрической активности интернейронов и мотонейронов спинного мозга крыс при гипотиреозе и гипертиреозе. Ж. Информационные технологии и управление, 2006, № 4 – 3, с. 46 – 51.
32. Хачатрян Т. С., Нагапетян Х. О., Матинян Л. А. Фитотерапия в сочетании с тироксином при органических повреждениях спинного мозга. Ж. Биолог. журн. Ар¬ме¬нии, 2008, № 4,т. LX, с. 51 – 55.
33. Хачатрян Т. С. Протекция тироксином изменений вызванной активности повреждённых травмой одиночных мотонейронов спинного мозга крыс. Ж. Биолог. журн. Армении, 2008, № 3,т. LX, с. 64 – 67.
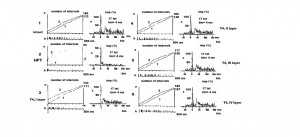
Рисунок 1. Внеклеточная фоновая (1) и вызванная (2) электрическая активность одиночного пирамидногох нейрона коры больших полушарий головного мозга мозга крыс в норме (I слой,1 а, б, в); одиночного пирамидного нейрона коры больших полушарий головного мозга мозга крыс при экспериментальном гипотиреозе (I cлой, 2 а, б, в); одиночного пирамидного нейрона I слоя коры больших полушарий головного мозга крыс при действии тироксина (3 а, б, в); одиночного пирамидного нейрона II слоя коры больших полушарий головного мозга крыс при действии тироксина (4 а, б, в); одиночного пирамидного нейрона III слоя коры больших полушарий головного мозга крыс при действии тироксина (5 а, б, в); одиночного пирамидного нейрона IV слоя коры больших полушарий головного мозга крыс при действии тироксина (6 а, б, в). На «а»: ордината – число импульсов, абсцисса – время регистрации импульсного потока. На «б»: картина импульсного потока в избранном интервале времени. На «в»: ордината – процент импульсов (в бинах) от числа проб, абсцисса – последовательность бинов.