Кальней О.С.
кафедра аналитической химии Алтайского государственного университета, e-mail: olgakalnei@yandex.ru
Целью работы являлся поиск и исследование свойств экстракционных систем, основанных на ионных жидкостях (ИЖ), которые могли бы обеспечить эффективное выделение и концентрирование ионов Ga (III) и In (III) из водных растворов. Помимо наиболее часто используемых в экстракции гидрофобных ИЖ – гексафторфосфата и бис(трифторметилсульфонил) имида 1-бутил-3- метилимидазолия (BMImPF6 и BMImTf2N ) – предложен и апробирован на практике способ применения гидрофильной ИЖ – тетрафторбората 1-бутил- 2,3 – диметилимидазолия (BM2ImTB) в жидкость-жидкостной экстракции Ga (III) и In (III), основанный на применении высаливателя.
Ключевые слова: экстракция металлов, ионные жидкости, высаливание, степень извлечения.
В современной химии одной из наиболее актуальных проблем является возможность перехода к экологически чистым процессам. Так, в аналитической химии все больше возрастает интерес к новому классу растворителей – ионным жидкостям. Благодаря таким свойствам, как нелетучесть, термическая стабильность, сравнительно высокая электропроводность, ИЖ удачно заменяют традиционные весьма токсичные органические растворители.
Ионные жидкости – органические соли, находящиеся в расплавленном состоянии. Особый интерес представляют ИЖ с температурой плавления ниже комнатной температуры, так как они наиболее удобны для применения в качестве растворителей. В большинстве работ по жидкость-жидкостной экстракции используют такие ИЖ, как гексафторфосфаты и бис(трифторметилсульфонил) имиды метилалкилимидазолия (чаще 1-бутил-3- метилимидазолия) [1-15]. Однако, к настоящему времени экстракции Ga (III) и In (III) достаточно хорошо изучена только в одну ИЖ – хлорид метилтри-н-октиламмония (Aliquat® 336). В работах [16 – 19] Aliquat® 336 применяли для экстракции Ga (III), In (III) и ещё ряда элементов: Fe (III), Co (II), Ni (II), Hg (II), Cd (II), Pd (II), Pt (II) и др. без дополнительных экстрагентов, но в присутствии одноименного аниона (Cl-) в водной фазе. Полученные результаты свидетельствовали о достаточно низкой селективности экстракции. В работе [20] определены максимальные коэффициенты распределения Ga (III) и In (III) из концентрированных солянокислых растворов (СHCl = 2 – 8 M) в растворы 0,5 М Aliquat® 336 в нитробензоле. При СHCl = 6 M ld Dmax = 2,5 и 2,0 для Ga (III) и In (III), соответственно. В работе [21] предложена экстракционно-фотометрическая методика определения Ga (III) , In (III) и некоторых других элементов в виде комплексов с ксиленоловым оранжевым. Экстракцию проводили равным объемом раствора Aliquat ® 336 (5 % масс.) в CHCl3. Количественная экстракция по данной методике наблюдается только для индия. При этом комплекс галлия не извлекался даже частично. Aliquat® 336 вообще был одной из первых ИЖ, использованной при экстракции, но, как правило, в качестве сорастворителя.
В настоящей работе детально изучена экстракция ионов Ga (III) и In (III) из водных фаз в имидазолиевые ИЖ без добавления органического растворителя, что делает такую экстракцию более экологичной, чем в системах с Aliquat ® 336.
Проведение эксперимента. Образование двухфазной системы с использованием гидрофобной ИЖ не вызывает затруднений и определяется лишь временем контакта фаз, необходимым для их полного разделения. Для того, чтобы получить водную расслаивающуюся систему с гидрофильной ИЖ, необходимо подобрать высаливатель. Непосредственно для самой экстракции следует определить величину области расслоения.
При изучении системы H2O – 1-бутил-2,3-диметилимидазолия тетрафторборат –высаливатель были построены изотермы растворимости. В качестве высаливателя использован сульфат аммония. Построение диаграмм растворимости дает наиболее полную картину фазовых равновесий. Анализ диаграмм позволяет сделать выводы не только о границах области расслаивания, но и характере взаимодействия компонентов, о количественном соотношении фаз в системе.
Состав трехкомпонентной системы удобно изображать, пользуясь треугольником Гиббса-Розебома (см. рисунок 1). Вершины равностороннего треугольника отвечают содержанию в системе 100% каждого из компонентов, т.е. соответствуют чистым веществам. На основании треугольника откладывают точки, отвечающие составу бинарной смеси ИЖ – соль. Затем эти точки соединяют с вершиной треугольника (H2O). На полученных отрезках откладывают значения %-ного содержания воды. Точки внутри треугольника описывают состав трехкомпонентной системы. Соединив эти точки, получают кривые линии, разделяющие треугольник на область монотектики, гетерогенную и гомогенную области. Построение изотерм растворимости проводили по 11 сечениям треугольника Гиббса-Розебома вышеуказанным методом.
Для проведения серии титрований готовили смеси ИЖ – (NH4)2SO4 содержащие (по весу) от 95% ИЖ и 5% (NH4)2SO4 до 5% ИЖ и 95% (NH4)2SO4. Приготовленные смеси поместили в градуированные пробирки на 10,00 мл и титровали дистиллированной водой. После добавления некоторого количества воды наблюдали появление мути вследствие образования второй фазы. Чтобы определить состав тройной системы, отвечающий границе перехода из однофазной области в двухфазную, находили, какой процент от общей массы смеси составляет каждый из компонентов.
Масс,% (ИЖ) = m(ИЖ) × 100% / m(cмеси) (1)
Масс,% ((NH4)2SO4) = m((NH4)2SO4) × 100% / m(cмеси) (2)
Масс,% (H2O) = 100 – (масс,% ИЖ + масс,% (NH4)2SO4) (3)
Далее смесь титровали до появления области расслоения, то есть появления двух жидких фаз. Процентное содержание каждого из компонентов находили по формулам (1), (2) и (3). Затем продолжили титрование до образования гомогенного раствора. Также рассчитали процентное содержание компонентов по вышеприведенным формулам. Следует отметить, что титрование необходимо проводить добавлением небольших порций воды. По мере приближения к моменту того или иного фазового перехода добавляется по 1 капле воды.
На рисунке 1 изображены полученные изотермы растворимости.
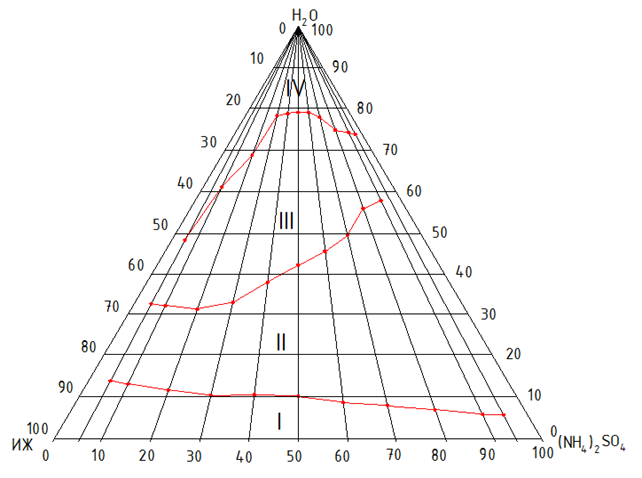
Рисунок 1 – Изотерма растворимости трехкомпонентной расслаивающейся системы H2O – 1-бутил-2,3-диметилимидазолия тетрафторборат – (NH4)2SO4
На концентрационном треугольнике (рисунок 1) можно выделить 4 основные области:
-
Поле совместной кристаллизации
-
Поле трехфазного монотектического равновесия, слагающееся из кристаллов и двух жидкостей
-
Область двухфазного жидкого равновесия
-
Поле ненасыщенного гомогенного раствора
Представляющая интерес область двухфазного жидкого равновесия занимает достаточно большую площадь концентрационного треугольника. Именно эта область используется в качестве экстракционной системы.
Методика анализа. Объем системы вода – BM2ImTB – сульфат аммония и оптимальное соотношение компонентов в ней определили при физико-химическом анализе системы и построении концентрационного треугольника Гиббса – Розебома. Установили, что при соотношении ИЖ : (NH4)2SO4 = 40 : 60 объем органической фазы составляет примерно 1/3 от общего объема системы, что обеспечивает достаточное концентрирование элемента. Для исследования экстракции In (III) и Ga (III) из систем с гидрофобными ИЖ, BMImTf2N и BMImPF6, также было выбрано соотношение компонентов вода: ИЖ = 3:1.
Прежде чем приступить к изучению экстракции комплексных соединений элементов необходимо было выявить комплексообразующую способность самих ИЖ. В связи с чем экспериментальная часть работы началась с экстракции Ga (III) и In (III) без введения в системы дополнительных комплексообразователей. В ходе эксперимента установили, что все три ИЖ малоэффективны при извлечении металлов из водных растворов.
Для экстракции ионов металлов в ионные жидкости практически всегда, как и в случае обычных растворителей, требуется подходящий комплексообразующий реагент. Поэтому для извлечения элементов с помощью ИЖ использовали реагенты, хорошо зарекомендовавшие себя при экстракции в обычные растворители.
Как известно из литературных источников [22-24], при выборе определенных условий экстракция Ga (III) и In (III) из галогенидных и псевдогалогенидных растворов в органические растворители становится количественной. Исходя из этих данных представлялось интересным исследовать экстракцию Ga (III) и In (III) ионными жидкостями в сопоставимых условиях.
Для проведения экстракции в системе вода – BM2ImTB – сульфат аммония в мерные пробирки на 10,00 мл вводили 0,80000 г BM2ImTB и 1,20000 г соли и 1,00 мл раствора металла, а для систем с BMImTf2N и BMImPF6 в пробирки вводили 0,70 мл ИЖ и также 1,00 мл раствора металла. Затем в системы вводили растворы реагентов–комплексообразователей (NH4Cl, KBr, KI, NH4SCN) с сохранением вышеуказанного соотношения органической и водной фаз Vорг : Vвод = 1 : 3. Пробирки с расслаивающейся системой интенсивно встряхивали в течение 10 минут и выдерживали при комнатной температуре до разделения фаз. Содержание металлов в фазах определяли комплексонометрическим титрованием раствором ЭДТА с различными индикаторами. По результатам титрования рассчитывали степень извлечения элементов (R, %).
Результаты экспериментов иллюстрируют рисунки 2 – 5.
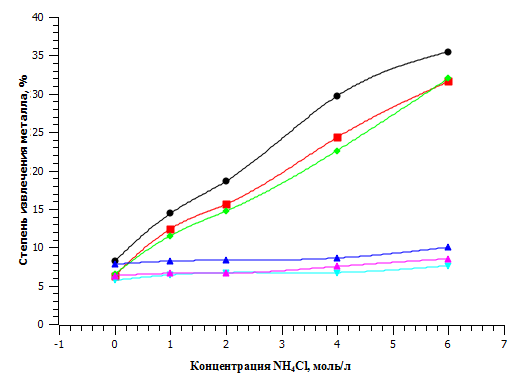
Рисунок 2 – Экстракция галлия (III) и индия(III) из хлоридных растворов
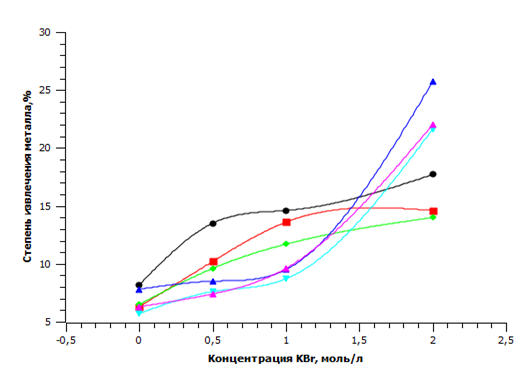
Рисунок 3 – Экстракция галлия (III) и индия(III) из бромидных растворов
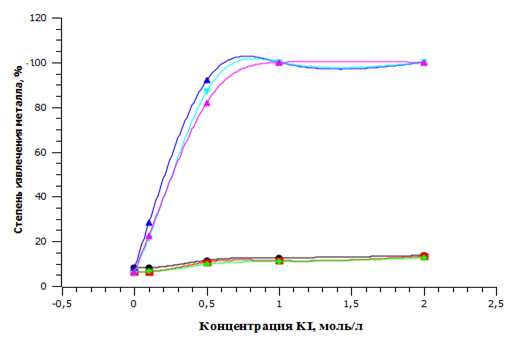
Рисунок 4 – Экстракция галлия (III) и индия (III) из иодидных растворов
*Обозначения на рисунках 2 – 4:
Сравнивая рисунки 2 – 4, можно видеть, что полнота извлечения элементов колеблется от незначителных %-ных содержаний до количественных, постепенно нарастая для индия при переходе от хлоридных к бромидным и, наконец, к иодидным растворам, а для галлия от иодидных к бромидным и затем хлоридным растворам. Полученные результаты согласуются с теоретическими представлениями координационной химии [25].

Рисунок 5 – Экстракция галлия (III) и индия(III) из тиоцианатных растворов
*Обозначения на рисунке 5:
Как видно из эксперименталных данных извлечение галлия (III) и индия (III) из тиоцианатных комплексов достаточно высокое во всем интервале выбранных концентраций тиоцианата аммония.
Обсуждение результатов: Изучена взаимная растворимость в трехкомпонентной системе H2O – 1-бутил-2,3-диметилимидазолия тетрафторборат – (NH4)2SO4. Построены изотермы растворимости этой системы при 250С. Установлено, что в системе имеется достаточно развитая область двухфазного жидкого равновесия, пригодная для экстракции элементов.
При экстракции Ga(III) и In(III) установлена низкая эффективность ИЖ, как комплексообразователей.
Использован прием повышения эффективности экстракции путем перевода элементов в галогенидные и тиоционатные комплексы. Максимальное извлечение наблюдается из иодидных растворов индия (˃ 99 %) при концентрации реагента СI- = 1,000 – 2,000 моль/л. и тиоцианатных комплексов обоих металлов (количественная экстракция при концентрации реагента СSCN- = 1,000 – 2,000 моль/л).
Отмечена наибольшая эффективность экстракционной системы H2O –1-бутил-3-метилимидазолия бис(трифторметилсульфонил) имид. Экстракционная способность ИЖ возрастает в ряду BM2ImTB ˂ BMImPF6 ˂ BMImTf2N.
Библиографический список
1. Джигайло Д.И. Экстракция ионов металлов из водных растворов ионными жидкостями, в том числе комплексообразующими: дис. …канд. хим. наук: 02.00.02 / Джигайло Дмитрий Иванович. – Москва, 2010. – 287 с.
2. Егоров В.М. Ионные жидкости для экстракции и создания химических сенсоров: дис. … канд. хим. наук: 02.00.02 / Егоров Владимир Михайлович. – Москва, 2008. – 198 с.
3. Хачатрян К.С. Применение ионных жидкостей для экстракции и определения органических соединений: дис. …канд. хим. наук: 02.00.02 / Хачатрян Кристине Суреновна. – Москва, 2006. – 173 с.
4. Туранов, А. Н. Влияние ионных жидкостей на экстракцию редкоземельных элементов из хлоридных растворов бидентатными нейтральными фосфорорганическими соединениями/ А.Н. Туранов, В. К. Карандашев, В. Е. Баулин // Журнал неорганической химии. – 2008. – Т. 53 – № 6, С. 1045 – 1050.
5. Visser, A.E. Liquid/liquid extraction of metal ions in room temperature ionic liquids / A.E. Visser, R.P. Swatloski, S.T. Griffin, D.H. Hartman, R.D. Rogers // Separation Science and Technology. – 2001. – V. 36. – P. 785 – 804.
6. Wei, G. Room temperature ionic liquid as a novel medium for liquid/liquid extraction of metal ions / G.-T. Wei , Z. Yang , C.-J. Chen // Analytica Chimica Acta. – 2003. – V. 488. – P. 183 – 192.
7. Visser, A.E. Task-specific ionic liquids for the extraction of metal ions from aqueous solutions / A.E. Visser, R.P. Swatloski, W.M. Reichert W.M. // Chemical Communications. – 2001. V. 32.– Is. 17. – P. 135 – 136.
8. Шведене, Н.В. Экстракционно- вольтамперометрическое определение катехоламинов с использованием растворителей нового класса – ионных жидкостей/ Н.В. Шведене, М.Ю. Немилова, К.С. Хачатрян, Н.А. Мамонов, А. В. Шухаев, А. А. Формановский, И. В. Плетнев // Вестник Московского университета. – Т. 45. – № 5. – 2004. – С. 324 – 332.
9. Smirnowa, S.V. Solvent extraction of amino acids into a room – temperature ionic liquid with dicyclohexano-18-crown-6/ S. V. Smirnowa, I. I. Torocheshnikova, A. A. Formanowsky, I.V. Pletnev // Bioanalytical Chemistry. – 2004. – V. 378. – P. 1369 – 1375.
10. Fan, Y.C. A ionic liquid for dispersive liquid-liquid microextraction of phenols/ Y. C. Fan, M. L. Chen, C. Shen-Tu, Y. Zhu // Analytical Chemistry. – 2009. – V. 64. – P. 1017 – 1022.
11. Wang, J.H. Direct extraction of double-stranded DNA into ionic liquid l-butyl-3-methylimidazolium hexafluorophosphate and its quantification / J.H. Wang, D.H. Cheng, X.W., Z. Du, Z.L. Fang // Analytical Chemistry. – 2007. – V. 79. – P. 620 – 625.
12. Cassol, C. C. On the Extraction of Aromatic Compounds from Hydrocarbons by Imidazolium Ionic Liquids / C. C. Cassol, A. P. Umpierre, G. Ebeling, B. Ferrera, S.S.X. Chiaro, J. Dupont // International Journal of Molecular Sciences. – 2007. – V. 8. –P. 593 – 605.
13. Pei, Y. Recovery of furfural from aqueous solution by ionic liquid based liquid- liquid extraction/ Y. Pei, K. Wu, J. Wang, J. Fan// Separation Science and Technology. – 2008. – V. 43. – P. 2090 – 2102.
14. Carda-Broch, S. Solvent properties of the 1-butyl-3-methylimidasolium hexafluorophosphate ionic liquid/ S. Carda-Broch, A. Berthod, D. W. Armstrong// Bioanalytical Chemistry. – 2003. – V. 375. – P. 191 – 199.
15. Dai, S. A Striking effect of ionic liquid anions in the extraction of Sr2+ and Cs+ by dicyclohexano-18-crown-6/ S. Dai, P. V. Bonnesen, T. J. Haverlock, B. A. Moyer, A. C Buchanan// Solvent extraction and ion exchange. – 2006. – V. 24. – P. 19 – 31.
16. Good, M. L. The nature of the halide complexes of Fe (III), Co (II), Ga (III), In (III) extracted from aqueous chloride media by high molecular weight substituted alkyl ammonium compounds / M. L. Good, S. C. Srivastava // Journal of Inorganic and Nuclear Chemistry. – 1965. – V. 27. – P. 2429 – 2436.
17. El-Wakil, A. M. Liquid-liquid extraction of iron(III), cobalt(II), nickel(II) and cadmium(II) from aqueous halide media with aliquat 336 / A. M. El-Wakil, A. B. Farag, A. Kh. Ez-Eldin // Fresenius’ Journal of Analytical Chemistry. – 1982. – V. 311. – P. 522.
18. Levitin, G. Solvent extraction of rhodium chloride from aqueous solutions and its separation from palladium and platinum / G. Levitin, G. Schmuckler // Reactive and functional polymers. – 2003. – V. 54. – P. 149 –154.
19. Fabrega, F. de M. Liquid-liquid extraction of mercury (II) from hydrochloric acid solutions by Aliquat 336 / F. de M. Fabrega, M.B. Mansur // Hydrometallurgy. – 2007. – V. 87. – Is. 34. – P. 83 – 90.
20. Bagreev, V.V. Mutual influence of metals in the extraction of their chloride complexes with tri-rc-octylamine and Aliquat 336 in nitrobenzene / V. V. Bagreev, C. Fischer, L. M. Kardivarenko, Yu. A. Zolotov // Polyhedron. – 1982. – V. 1. – Is. 78. –P. 623 – 627.
21. Pribil, R. Extractions with long-chain amines I. Extraction of some metal-xylenol orange complexes into methyltrioctylammonium chloride (Aliquat 336-S) / R. Pribil, V. Vesely // Talanta. – 1970. – V. 17. – P. 801 – 805.
22. Дымов, А.М. Аналитическая химия Ga3+ [Текст] / А.М. Дымов, А.П. Савостин. – М.: Наука, 1968. – 256 с.
23. Бусев, А. И. Руководство по аналитической химии редких элементов [Текст] / А.И. Бусев, В.Г. Типцова, В.М. Иванов. 2-е изд., перераб. и доп. – М.: Химия, 1978. – 432 с.
24. Бусев, А.И. Аналитическая химия индия [Текст] / А.И. Бусев. – М.: Институт геохимии и аналитической химии им. В. И. Вернадского. – 1958 г. – 244 с.
25. Спиваков, Б.Я., Петрухин О.М. Экстракция галогенидных комплексов металлов с позиций координационной химии / Б.Я. Спиваков, О.М. Петрухин // Журнал неорганической химии. – 1980. – Т. 25. – №1. – С. 249 – 259.